–Ü–æ–Ω–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –∑–∞ —É—á–∞—Å—Ç—é —ñ–æ–Ω—ñ–≤. –Ü–æ–Ω–∏ –ø–æ–≤–∏–Ω–Ω—ñ –±—É—Ç–∏ –±—ñ–ª—å—à-–º–µ–Ω—à —Ä—É—Ö–ª–∏–≤–∏–º–∏. –Ü–æ–Ω–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –Ω–µ –º–æ–∂—É—Ç—å –ø—Ä–æ—Ç—ñ–∫–∞—Ç–∏ –º—ñ–∂ –∑–≤’—è–∑–∞–Ω–∏–º–∏ —ñ–æ–Ω–∞–º–∏, —è–∫—ñ –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è —É –≤—É–∑–ª–∞—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ —ñ–æ–Ω–Ω–∏—Ö —Å–ø–æ–ª—É–∫. –í—ñ–ª—å–Ω—ñ, —Ç–æ–±—Ç–æ –¥–æ—Å–∏—Ç—å —Ä—É—Ö–ª–∏–≤—ñ —ñ–æ–Ω–∏ –Ω–µ–æ–±—Ö—ñ–¥–Ω—ñ —â–æ–± –≤—ñ–¥–±—É–ª–∏—Å—è —ñ–æ–Ω–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó, –∑’—è–≤–ª—è—é—Ç—å—Å—è —Ç—ñ–ª—å–∫–∏ –≤ —Ä–æ–∑–ø–ª–∞–≤–∞—Ö –∞–±–æ –≤ —Ä–æ–∑—á–∏–Ω–∞—Ö –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —Ä–æ–∑–ø–ª–∞–≤–ª–µ–Ω–∏—Ö –∞–±–æ —Ä–æ–∑—á–∏–Ω–µ–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω.
–ï–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–∞ –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—è – —Ü–µ —Ä–æ–∑–ø–∞–¥ —Ä–µ—á–æ–≤–∏–Ω –≤ —Ä–æ–∑–ø–ª–∞–≤—ñ –∞–±–æ –≤ —Ä–æ–∑—á–∏–Ω—ñ –Ω–∞ –≤—ñ–ª—å–Ω—ñ —ñ–æ–Ω–∏, –∑ —è–∫–∏—Ö –≤–æ–Ω–∏ —Å–∫–ª–∞–¥–µ–Ω—ñ.
–ü—Ä–∏–∫–ª–∞–¥.
–ù–∞—Ç—Ä—ñ–π —Ö–ª–æ—Ä–∏–¥ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —ñ –≤ —Ä–æ–∑–ø–ª–∞–≤—ñ, —ñ –≤ —Ä–æ–∑—á–∏–Ω—ñ —É—Ç–≤–æ—Ä—é—î –∫–∞—Ç—ñ–æ–Ω–∏ –Ω–∞—Ç—Ä—ñ—é —ñ —Ö–ª–æ—Ä–∏–¥-—ñ–æ–Ω–∏:
NaCl ‚áÑ Na+ + Cl–
–°–ø–æ–ª—É–∫–∏ –∑ –ø–µ—Ä–µ–≤–∞–∂–Ω–æ —ñ–æ–Ω–Ω–∏–º–∏ –∑–≤’—è–∑–∫–∞–º–∏, —Ç–∞–∫—ñ, —è–∫ —Å–æ–ª—ñ, –≤ —Ç–≤–µ—Ä–¥–æ–º—É —Å—Ç–∞–Ω—ñ —î –∫—Ä–∏—Å—Ç–∞–ª–∞–º–∏, —É –≤—É–∑–ª–∞—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ —è–∫–∏—Ö –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è –∑–≤’—è–∑–∞–Ω—ñ –º—ñ–∂ —Å–æ–±–æ—é —ñ–æ–Ω–∏. –ü—Ä–∏ –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—ñ —ñ–æ–Ω–Ω–∏—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ–≤, –¥–æ —è–∫–∏—Ö –≤—ñ–¥–Ω–æ—Å–∏—Ç—å—Å—è –Ω–∞—Ç—Ä—ñ–π —Ö–ª–æ—Ä–∏–¥, –µ–Ω–µ—Ä–≥—ñ—è –∫–æ–ª–∏–≤–∞–Ω–Ω—è —ñ–æ–Ω—ñ–≤ —É –≤—É–∑–ª–∞—Ö —Ä–µ—à—ñ—Ç–∫–∏ –∑—Ä–æ—Å—Ç–∞—î –¥–æ —Ç–∏—Ö –ø—ñ—Ä, –ø–æ–∫–∏ –Ω–µ –±—É–¥—É—Ç—å –ø–æ–¥–æ–ª–∞–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω—ñ —Å–∏–ª–∏ —Ç—è–∂—ñ–Ω–Ω—è, —â–æ –∑–∞–±–µ–∑–ø–µ—á—É—é—Ç—å —Å—Ç—ñ–π–∫—ñ—Å—Ç—å —ñ–æ–Ω–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏. –í —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∞ —Ä–µ—à—ñ—Ç–∫–∞ —Ä—É–π–Ω—É—î—Ç—å—Å—è, —Ä–µ—á–æ–≤–∏–Ω–∞ –ø–ª–∞–≤–∏—Ç—å—Å—è (—Å—Ç–∞—î —Ä—ñ–¥–∫–æ—é), –∞ —ñ–æ–Ω–∏ —è–∫—ñ –≤–∏–≤—ñ–ª—å–Ω—è—é—Ç—å—Å—è –Ω–∞–±—É–≤–∞—é—Ç—å –Ω–µ–æ–±—Ö—ñ–¥–Ω–æ—ó —Ä—É—Ö–ª–∏–≤–æ—Å—Ç—ñ. –£—Ç–≤–æ—Ä–µ–Ω–∏–π —Ä–æ–∑–ø–ª–∞–≤ –ø—Ä–æ–≤–æ–¥–∏—Ç—å –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–π —Å—Ç—Ä—É–º –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ –ø—Ä–∏—Å—É—Ç–Ω–æ—Å—Ç—ñ –≤—ñ–ª—å–Ω–∏—Ö –∑–∞—Ä—è–¥–∂–µ–Ω–∏—Ö —ñ–æ–Ω—ñ–≤, —ñ–æ–Ω–∏ –º–æ–∂—É—Ç—å –±—Ä–∞—Ç–∏ —É—á–∞—Å—Ç—å –≤ —ñ–æ–Ω–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ—è—Ö.
–ú–µ—Ö–∞–Ω—ñ–∑–º –ø—Ä–æ—Ü–µ—Å—É —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –≤—ñ–ª—å–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ –≤ —Ä–æ–∑—á–∏–Ω—ñ –¥–µ—â–æ —ñ–Ω—à–∏–π, —â–æ –∑—É–º–æ–≤–ª–µ–Ω–æ —ñ–Ω—à–æ—é –ø—Ä–∏—á–∏–Ω–æ—é —Ä–æ–∑—Ä–∏–≤—É —Ö—ñ–º—ñ—á–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ–π —Ä–µ—à—ñ—Ç—Ü—ñ —ñ–æ–Ω–Ω–∏—Ö —Å–ø–æ–ª—É–∫. –Ý—É–π–Ω—É–≤–∞–Ω–Ω—è —ñ–æ–Ω—ñ–≤ —Ä–µ—à—ñ—Ç–∫–∏ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –ø—ñ–¥ –≤–ø–ª–∏–≤–æ–º —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∞, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ –≤–æ–¥–∏. –ü–æ–ª—è—Ä–Ω—ñ –º–æ–ª–µ–∫—É–ª–∏ –≤–æ–¥–∏ –Ω–∞—Å—Ç—ñ–ª—å–∫–∏ –∑–Ω–∏–∂—É—é—Ç—å —Å–∏–ª–∏ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–æ–≥–æ —Ç—è–∂—ñ–Ω–Ω—è –º—ñ–∂ —ñ–æ–Ω–∞–º–∏ –≤ —Ä–µ—à—ñ—Ç—Ü—ñ (–ø—Ä–∏–±–ª–∏–∑–Ω–æ —É 80 —Ä–∞–∑—ñ–≤), —â–æ —ñ–æ–Ω–∏ —Å—Ç–∞—é—Ç—å –≤—ñ–ª—å–Ω–∏–º–∏ —ñ –ø–µ—Ä–µ—Ö–æ–¥—è—Ç—å –≤ —Ä–æ–∑—á–∏–Ω. –¢–∞–∫–∏–º —á–∏–Ω–æ–º, –ø—Ä–æ—Ü–µ—Å —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—è —É –≤–æ–¥—ñ —ñ–æ–Ω–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –æ–±–æ–≤’—è–∑–∫–æ–≤–æ —Å—É–ø—Ä–æ–≤–æ–¥–∂—É—î—Ç—å—Å—è —Ä–æ–∑–ø–∞–¥–æ–º –Ω–∞ —ñ–æ–Ω–∏. –Ý–æ–∑—á–∏–Ω–∏, —è–∫—ñ —É—Ç–≤–æ—Ä–∏–ª–∏—Å—è –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—è —ñ–æ–Ω–Ω–∏—Ö —Å–ø–æ–ª—É–∫ –µ–ª–µ–∫—Ç—Ä–æ–ø—Ä–æ–≤—ñ–¥–Ω—ñ.
–¢–µ–æ—Ä—ñ—è –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó –∞–±–æ —ñ–æ–Ω–Ω–∞ —Ç–µ–æ—Ä—ñ—è –±—É–ª–∞ —Å—Ç–≤–æ—Ä–µ–Ω–∞ –≤ 1884-1887 —Ä–æ–∫–∞—Ö —à–≤–µ–¥—Å—å–∫–∏–º —Ö—ñ–º—ñ–∫–æ–º –°–≤–∞–Ω—Ç–µ –ê—Ä—Ä–µ–Ω—ñ—É—Å–æ–º. –¶—è –∫–ª–∞—Å–∏—á–Ω–∞ —Ç–µ–æ—Ä—ñ—è –¥–æ–∑–≤–æ–ª–∏–ª–∞ –ø–æ—è—Å–Ω–∏—Ç–∏ –µ–ª–µ–∫—Ç—Ä–æ–ø—Ä–æ–≤—ñ–¥–Ω—ñ—Å—Ç—å —Ä–æ–∑–ø–ª–∞–≤—ñ–≤ —ñ —Ä–æ–∑—á–∏–Ω—ñ–≤ —ñ –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π –º—ñ–∂ —Ä–æ–∑–ø–ª–∞–≤–ª–µ–Ω–∏–º–∏ —ñ —Ä–æ–∑—á–∏–Ω–µ–Ω–∏–º–∏ —Ä–µ—á–æ–≤–∏–Ω–∞–º–∏.
–Ý–æ–∑–ø–∞–¥ –Ω–∞ —ñ–æ–Ω–∏ –º–æ–∂–ª–∏–≤–∏–π —Ç–∞–∫–æ–∂ –¥–ª—è –±–∞–≥–∞—Ç—å–æ—Ö –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, —Ç–∞–∫–∏—Ö —è–∫ HCl (–≥–∞–∑) –∞–±–æ HNO3 (—Ä—ñ–¥–∏–Ω–∞). –¶—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –ø—Ä–∏ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—ñ –≤ –≤–æ–¥—ñ, —Ö–æ—á–∞ –≤–æ–Ω–∏ —ñ –ø–æ–±—É–¥–æ–≤–∞–Ω—ñ –∑ —ñ–æ–Ω—ñ–≤, –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ –¥–∏—Å–æ—Ü—ñ—é—é—Ç—å –∑ —Ä–æ–∑—Ä–∏–≤–æ–º –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É (H-Cl –∞–±–æ H-O):
HCl ‚áÑ H+ + Cl–; HNO3 ‚áÑ H+ + NO3–
–ï–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω—É –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—é —Ä–µ—á–æ–≤–∏–Ω –≤ —Ä–æ–∑—á–∏–Ω—ñ –≤–∏–∫–ª–∏–∫–∞—î –Ω–µ —Ç—ñ–ª—å–∫–∏ –≤–æ–¥–∞, –∞–ª–µ —ñ –Ω–µ–≤–æ–¥–Ω—ñ –ø–æ–ª—è—Ä–Ω—ñ —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∏, —Ç–∞–∫—ñ —è–∫ —Ä—ñ–¥–∫–∏–π –∞–º–æ–Ω—ñ–∞–∫ —ñ —Ä—ñ–¥–∫–∏–π —Å—É–ª—å—Ñ—É—Ä –¥—ñ–æ–∫—Å–∏–¥. –û–¥–Ω–∞–∫ —Å–∞–º–µ –¥–ª—è –≤–æ–¥–∏ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ –ø–æ—Å–ª–∞–±–ª—é–≤–∞—Ç–∏ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–µ —Ç—è–∂—ñ–Ω–Ω—è –º—ñ–∂ —ñ–æ–Ω–∞–º–∏ –≤ —Ä–µ—à—ñ—Ç—Ü—ñ –≤–∏—Ä–∞–∂–µ–Ω–æ –æ—Å–æ–±–ª–∏–≤–æ —è—Å–∫—Ä–∞–≤–æ. –ú—ñ—Ä–æ—é —Ü—å–æ–≥–æ –≤–ø–ª–∏–≤—É —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∞ —î –π–æ–≥–æ –≤—ñ–¥–Ω–æ—Å–Ω–∞ –¥—ñ–µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∞ –ø—Ä–æ–Ω–∏–∫–Ω—ñ—Å—Ç—å, –∑–Ω–∞—á–µ–Ω–Ω—è —è–∫–æ—ó –¥–ª—è –≤–æ–¥–∏ –≤–µ–ª—å–º–∏ –≤–∏—Å–æ–∫–µ.
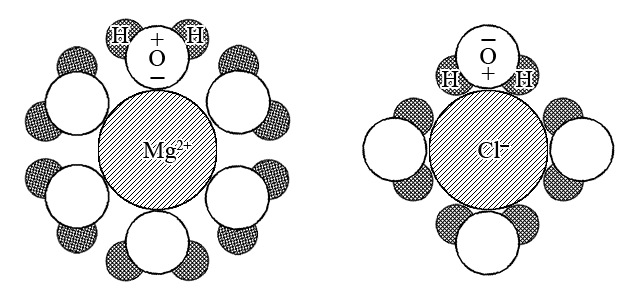
–í—ñ–ª—å–Ω—ñ —ñ–æ–Ω–∏, —è–∫—ñ –æ–ø–∏–Ω–∏–ª–∏—Å—è —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —Ä–æ–∑—á–∏–Ω–µ–Ω–æ—ó —Ä–µ—á–æ–≤–∏–Ω–∏, –æ—Ö–æ–ø–ª—é—é—Ç—å—Å—è –ø–æ–ª—è—Ä–Ω–∏–º–∏ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤–æ–¥–∏: –Ω–∞–≤–∫–æ–ª–æ —ñ–æ–Ω—ñ–≤ –≤ —Ä–æ–∑—á–∏–Ω—ñ –∑’—è–≤–ª—è—î—Ç—å—Å—è –≥—ñ–¥—Ä–∞—Ç–Ω–∞ –æ–±–æ–ª–æ–Ω–∫–∞ –≤ —Ä–∞–∑—ñ —ñ–Ω—à–∏—Ö —Ä–æ–∑—á–∏–Ω–Ω–∏–∫—ñ–≤ —Å–æ–ª—å–≤–∞—Ç–Ω–∞ –æ–±–æ–ª–æ–Ω–∫–∞.
–ì—ñ–¥—Ä–∞—Ç–∞—Ü—ñ—è – —Ü–µ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –æ–±–æ–ª–æ–Ω–∫–∏ –∑ –º–æ–ª–µ–∫—É–ª –≤–æ–¥–∏ –Ω–∞–≤–∫–æ–ª–æ —ñ–æ–Ω–∞, –æ–±—É–º–æ–≤–ª–µ–Ω–µ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–∏–º —Ç—è–∂—ñ–Ω–Ω—è–º –¥–∏–ø–æ–ª—ñ–≤ –≤–æ–¥–∏ –¥–æ —ñ–æ–Ω–∞.
–°–æ–ª—å–≤–∞—Ç–∞—Ü—ñ—è – —Ü–µ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –æ–±–æ–ª–æ–Ω–∫–∏ –∑ –º–æ–ª–µ–∫—É–ª —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∞ –Ω–∞–≤–∫–æ–ª–æ —ñ–æ–Ω–∞, –æ–±—É–º–æ–≤–ª–µ–Ω–µ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–∏–º —Ç—è–∂—ñ–Ω–Ω—è–º –¥–∏–ø–æ–ª—ñ–≤ –º–æ–ª–µ–∫—É–ª —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∞ –¥–æ —ñ–æ–Ω–∞.
–ü—Ä–∏—Ä–æ–¥–Ω–æ, —â–æ –Ω–∞–≤–∫–æ–ª–æ –ø–æ–∑–∏—Ç–∏–≤–Ω–∏—Ö —ñ–æ–Ω—ñ–≤, –º–æ–ª–µ–∫—É–ª–∏ –≤–æ–¥–∏ –æ—Ä—ñ—î–Ω—Ç–æ–≤–∞–Ω—ñ –Ω–µ–≥–∞—Ç–∏–≤–Ω–∏–º–∏ –∫—ñ–Ω—Ü—è–º–∏ –¥–∏–ø–æ–ª—ñ–≤, –∞ –Ω–∞–≤–∫–æ–ª–æ –Ω–µ–≥–∞—Ç–∏–≤–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ – –ø–æ–∑–∏—Ç–∏–≤–Ω–∏–º–∏ –∫—ñ–Ω—Ü—è–º–∏ –¥–∏–ø–æ–ª—ñ–≤.
–ö–∞—Ç—ñ–æ–Ω–∏ —ñ –∞–Ω—ñ–æ–Ω–∏
–Ø–∫—â–æ —á–µ—Ä–µ–∑ —Ä–æ–∑—á–∏–Ω –∞–±–æ —Ä–æ–∑–ø–ª–∞–≤, —â–æ –º—ñ—Å—Ç–∏—Ç—å –¥–æ—Å—Ç–∞—Ç–Ω—å–æ —Ä—É—Ö–ª–∏–≤—ñ —ñ–æ–Ω–∏, –ø—Ä–æ—Ç—ñ–∫–∞—î –ø–æ—Å—Ç—ñ–π–Ω–∏–π –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–π —Å—Ç—Ä—É–º (–ø—Ä–∏ –∑–∞–Ω—É—Ä–µ–Ω–Ω—ñ –≤ —Ä–æ–∑—á–∏–Ω –∞–±–æ —Ä–æ–∑–ø–ª–∞–≤ –¥–≤–æ—Ö –µ–ª–µ–∫—Ç—Ä–æ–¥—ñ–≤), —Ç–æ —ñ–æ–Ω–∏ –ø–æ—á–∏–Ω–∞—é—Ç—å —Ä—É—Ö–∞—Ç–∏—Å—è –ø–µ–≤–Ω–∏–º —á–∏–Ω–æ–º. –ó–∞ –≤—ñ–¥—Å—É—Ç–Ω–æ—Å—Ç—ñ –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–æ–≥–æ –ø–æ–ª—è (–µ–ª–µ–∫—Ç—Ä–∏—á–Ω–æ–≥–æ —Å—Ç—Ä—É–º—É) —ñ–æ–Ω–∏ –≤ —Ä–æ–∑—á–∏–Ω—ñ –∞–±–æ —Ä–æ–∑–ø–ª–∞–≤—ñ —Ä—É—Ö–∞—é—Ç—å—Å—è —Ö–∞–æ—Ç–∏—á–Ω–æ.

–í–Ω–∞—Å–ª—ñ–¥–æ–∫ –¥—ñ—ó –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–æ–≥–æ –ø–æ–ª—è —ñ–æ–Ω–∏ —Ä—É—Ö–∞—é—Ç—å—Å—è –≤ –±—ñ–∫ –µ–ª–µ–∫—Ç—Ä–æ–¥—É, —è–∫–∏–π –º–∞—î –ø—Ä–æ—Ç–∏–ª–µ–∂–Ω–∏–π —ó–º –∑–∞ –∑–Ω–∞–∫–æ–º –∑–∞—Ä—è–¥.
–ó–∞ –Ω–∞–∑–≤–æ—é –µ–ª–µ–∫—Ç—Ä–æ–¥–∞, –≤ –±—ñ–∫ —è–∫–æ–≥–æ —Ä—É—Ö–∞—é—Ç—å—Å—è —ñ–æ–Ω–∏, —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –Ω–∞–∑–≤–∞ —ñ–æ–Ω—ñ–≤.
–ö–∞—Ç–æ–¥ – —Ü–µ –Ω–µ–≥–∞—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω–∏–π –µ–ª–µ–∫—Ç—Ä–æ–¥; –ö–∞—Ç—ñ–æ–Ω–∏ – —Ü–µ –ø–æ–∑–∏—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω—ñ —ñ–æ–Ω–∏.
–ê–Ω–æ–¥ – —Ü–µ –ø–æ–∑–∏—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω–∏–π –µ–ª–µ–∫—Ç—Ä–æ–¥; –ê–Ω—ñ–æ–Ω–∏ – —Ü–µ –Ω–µ–≥–∞—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω—ñ —ñ–æ–Ω–∏.
–ö–∞—Ç—ñ–æ–Ω–∏ –º–∞—é—Ç—å –ø–æ–∑–∏—Ç–∏–≤–Ω–∏–π –∑–∞—Ä—è–¥ —ñ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ, —Ä—É—Ö–∞—é—Ç—å—Å—è –≤ –±—ñ–∫ –Ω–µ–≥–∞—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω–æ–≥–æ –∫–∞—Ç–æ–¥–∞; –∞–Ω—ñ–æ–Ω–∏ –º–∞—é—Ç—å –Ω–µ–≥–∞—Ç–∏–≤–Ω–∏–π –∑–∞—Ä—è–¥ —ñ —Ä—É—Ö–∞—é—Ç—å—Å—è –≤ –±—ñ–∫ –ø–æ–∑–∏—Ç–∏–≤–Ω–æ –∑–∞—Ä—è–¥–∂–µ–Ω–æ–≥–æ –∞–Ω–æ–¥–∞.
–î–æ –ø–æ—à–∏—Ä–µ–Ω–∏—Ö –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –≤—ñ–¥–Ω–æ—Å—è—Ç—å—Å—è: —ñ–æ–Ω–∏ –º–µ—Ç–∞–ª—ñ–≤ (Na+, Ca2+, Al3+, Cu2+, Ag+, Au+ —ñ —ñ–Ω.); —ñ–æ–Ω –≥—ñ–¥—Ä–æ–≥–µ–Ω—É H+ (—Ç–æ—á–Ω—ñ—à–µ, H3O+), —Å–∫–ª–∞–¥–Ω—ñ —ñ–æ–Ω–∏, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –∫–∞—Ç—ñ–æ–Ω –∞–º–æ–Ω—ñ—é NH4+.
–î–æ –ø–æ—à–∏—Ä–µ–Ω–∏—Ö –∞–Ω—ñ–æ–Ω—ñ–≤ –≤—ñ–¥–Ω–æ—Å—è—Ç—å—Å—è –≤—Å—ñ –∫–∏—Å–ª–æ—Ç–Ω—ñ –∑–∞–ª–∏—à–∫–∏ (Cl–, SO42-, NO3– —Ç–∞ —ñ–Ω.), –≥—ñ–¥—Ä–æ–∫—Å–∏–¥-—ñ–æ–Ω OH–.
–£ —Ñ–æ—Ä–º—É–ª–∞—Ö –Ω–µ–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫ —Ñ–æ—Ä–º—É–ª—É –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –≤–∫–∞–∑—É—é—Ç—å –∑–ª—ñ–≤–∞, –∞ —Ñ–æ—Ä–º—É–ª—É –∞–Ω—ñ–æ–Ω—ñ–≤ —Å–ø—Ä–∞–≤–∞.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥: NaCl – Na+ – –∫–∞—Ç—ñ–æ–Ω; Cl– – –∞–Ω—ñ–æ–Ω.
–£ –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –≤—Å—ñ —ñ–æ–Ω–∏ –≥—ñ–¥—Ä–∞—Ç–æ–≤–∞–Ω—ñ –ø–µ–≤–Ω–∏–º —á–∏—Å–ª–æ–º –º–æ–ª–µ–∫—É–ª –≤–æ–¥–∏, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, Na+*nH2O, SO42-*nH2O, H+*nH2O –∞–±–æ H3O+*(h-1)H2O. –©–æ–± –Ω–µ —É—Å–∫–ª–∞–¥–Ω—é–≤–∞—Ç–∏ –∑–∞–ø–∏—Å —Ä—ñ–≤–Ω—è–Ω—å —Ö—ñ–º—ñ—á–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π –∑–∞ —É—á–∞—Å—Ç—é —ñ–æ–Ω—ñ–≤ –≤ —Ä–æ–∑—á–∏–Ω—ñ, –∑–∞–∑–≤–∏—á–∞–π –≥—ñ–¥—Ä–∞—Ç–Ω–∞ –æ–±–æ–ª–æ–Ω–∫–∞ –Ω–µ –≤–∫–∞–∑—É—î—Ç—å—Å—è (–∫—Ä—ñ–º –æ—Å–æ–±–ª–∏–≤–∏—Ö –≤–∏–ø–∞–¥–∫—ñ–≤); –≤ –∑–∞–ø–∏—Å–∞—Ö Na+, SO42-, H+ –º–∞—î—Ç—å—Å—è –Ω–∞ —É–≤–∞–∑—ñ, —â–æ —Ü—ñ —ñ–æ–Ω–∏ –≤ —Ä–æ–∑—á–∏–Ω—ñ –≥—ñ–¥—Ä–∞—Ç–æ–≤–∞–Ω—ñ.
–ï–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ —ñ –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏
–ó–∞ –∑–¥–∞—Ç–Ω—ñ—Å—Ç—é —Ä–µ—á–æ–≤–∏–Ω —Ä–æ–∑–ø–∞–¥–∞—Ç–∏—Å—è –∞–±–æ –Ω–µ —Ä–æ–∑–ø–∞–¥–∞—Ç–∏—Å—è –≤ —Ä–æ–∑–ø–ª–∞–≤—ñ –∞–±–æ –≤ —Ä–æ–∑—á–∏–Ω—ñ –Ω–∞ –∫–∞—Ç—ñ–æ–Ω–∏ —ñ –∞–Ω—ñ–æ–Ω–∏ —Ä–æ–∑—Ä—ñ–∑–Ω—è—é—Ç—å –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ —ñ –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏.
–ï–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ – —Ü–µ —Ä–µ—á–æ–≤–∏–Ω–∏, —è–∫—ñ –ø—ñ–¥–¥–∞—é—Ç—å—Å—è –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω—ñ–π –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó, –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ —á–æ–≥–æ —ó—Ö —Ä–æ–∑–ø–ª–∞–≤–∏ –∞–±–æ —Ä–æ–∑—á–∏–Ω–∏ –ø—Ä–æ–≤–æ–¥—è—Ç—å –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–π —Å—Ç—Ä—É–º.
–î–æ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ –Ω–∞–ª–µ–∂–∞—Ç—å –≤—Å—ñ —Å–æ–ª—ñ, –∞ —Ç–∞–∫–æ–∂ –∫–∏—Å–ª–æ—Ç–Ω—ñ, –æ—Å–Ω–æ–≤–Ω—ñ —Ç–∞ –∞–º—Ñ–æ—Ç–µ—Ä–Ω—ñ –≥—ñ–¥—Ä–æ–∫—Å–∏–¥–∏.
–°–ª—ñ–¥ —Ä–æ–∑—Ä—ñ–∑–Ω—è—Ç–∏ —ñ—Å—Ç–∏–Ω–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ (—Å–ø—Ä–∞–≤–∂–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏) —ñ –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏.
–Ü—Å—Ç–∏–Ω–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ —Å–∫–ª–∞–¥–µ–Ω—ñ –∑ —ñ–æ–Ω—ñ–≤ –≤–∂–µ –≤ —ñ–Ω–¥–∏–≤—ñ–¥—É–∞–ª—å–Ω–æ–º—É —Å—Ç–∞–Ω—ñ, —Ç–æ–±—Ç–æ –¥–æ —Ç–æ–≥–æ, —è–∫ –≤–æ–Ω–∏ –±—É–¥—É—Ç—å —Ä–æ–∑–ø–ª–∞–≤–ª–µ–Ω—ñ –∞–±–æ –ø–µ—Ä–µ–≤–µ–¥–µ–Ω—ñ –≤ —Ä–æ–∑—á–∏–Ω. –î–æ —ñ—Å—Ç–∏–Ω–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ –Ω–∞–ª–µ–∂–∞—Ç—å –≤—Å—ñ —Ç–∏–ø–æ–≤—ñ —Å–æ–ª—ñ, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, NaNO3, K2SO4, CaCl2 —ñ —ñ–Ω., —è–∫—ñ –≤ —Ç–≤–µ—Ä–¥–æ–º—É —Å—Ç–∞–Ω—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å —ñ–æ–Ω–Ω—É –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—É —Ä–µ—à—ñ—Ç–∫—É.
–ü–æ—Ç–µ–Ω—Ü—ñ–π–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ –≤ —ñ–Ω–¥–∏–≤—ñ–¥—É–∞–ª—å–Ω–æ–º—É —Å—Ç–∞–Ω—ñ —ñ–æ–Ω—ñ–≤ –Ω–µ –º—ñ—Å—Ç—è—Ç—å, –∞–ª–µ —É—Ç–≤–æ—Ä—é—é—Ç—å —ó—Ö –ø—Ä–∏ –ø–µ—Ä–µ—Ö–æ–¥—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –≤ —Ä–æ–∑—á–∏–Ω. –î–æ –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ –Ω–∞–ª–µ–∂–∞—Ç—å —Ä–µ—á–æ–≤–∏–Ω–∏, —â–æ —Å–∫–ª–∞–¥–∞—é—Ç—å—Å—è –∑ –º–æ–ª–µ–∫—É–ª –∑ —Å–∏–ª—å–Ω–æ –ø–æ–ª—è—Ä–Ω–∏–º–∏ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏–º–∏ –∑–≤’—è–∑–∫–∞–º–∏. –£ –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ —Ç–∞–∫—ñ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω—ñ –∑–≤’—è–∑–∫–∏ –ø—ñ–¥ –≤–ø–ª–∏–≤–æ–º –ø–æ–ª—è—Ä–Ω–∏—Ö –º–æ–ª–µ–∫—É–ª —Ä–æ–∑—á–∏–Ω–Ω–∏–∫–∞ —Ä–æ–∑—Ä–∏–≤–∞—é—Ç—å—Å—è, –∞–±–æ —É –≤—Å—ñ—Ö –º–æ–ª–µ–∫—É–ª, –∞–±–æ –¥–∏—Å–æ—Ü—ñ—é—î –ª–∏—à–µ —á–∞—Å—Ç–∏–Ω–∞ –º–æ–ª–µ–∫—É–ª.
–ü—Ä–∏–∫–ª–∞–¥.
–ü—Ä–∏ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—ñ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–≥–æ –≥—ñ–¥—Ä–æ–≥–µ–Ω—Ö–ª–æ—Ä–∏–¥—É —É –≤–æ–¥—ñ —Å–∏–ª—å–Ω–æ –ø–æ–ª—è—Ä–Ω—ñ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω—ñ –∑–≤’—è–∑–∫–∏ H-Cl —Ä–æ–∑—Ä–∏–≤–∞—é—Ç—å—Å—è, —ñ —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –∫–∞—Ç—ñ–æ–Ω–∏ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É H+ (H3O+) —ñ —Ö–ª–æ—Ä–∏–¥-—ñ–æ–Ω–∏ Cl–:
HCl ‚áÑ H+ + Cl–; H+ + H2O = H3O+
–í–æ–¥–Ω–∏–π —Ä–æ–∑—á–∏–Ω –≥—ñ–¥—Ä–æ–≥–µ–Ω—Ö–ª–æ—Ä–∏–¥—É —á–µ—Ä–µ–∑ –Ω–∞—è–≤–Ω—ñ—Å—Ç—å –∫–∞—Ç—ñ–æ–Ω—ñ–≤ H+ –º–∞—î –∫–∏—Å–ª–æ—Ç–Ω—É —Ä–µ–∞–∫—Ü—ñ—é, —Ç–æ–º—É —Ä–æ–∑—á–∏–Ω –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ö–ª–æ—Ä–∏–¥—É –Ω–∞–∑–∏–≤–∞—é—Ç—å —Ö–ª–æ—Ä–∏–¥–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ –∞–±–æ —Å–æ–ª—è–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞.
–Ý–µ—á–æ–≤–∏–Ω–∏, –ø–æ–±—É–¥–æ–≤–∞–Ω—ñ –∑ –º–æ–ª–µ–∫—É–ª –∑ –Ω–µ–ø–æ–ª—è—Ä–Ω–∏–º–∏ –∞–±–æ —Å–ª–∞–±–æ –ø–æ–ª—è—Ä–Ω–∏–º–∏ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏–º–∏ –∑–≤’—è–∑–∫–∞–º–∏, —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –Ω–µ –¥–∏—Å–æ—Ü—ñ—é—é—Ç—å –Ω–∞ —ñ–æ–Ω–∏, –∞ –∑–∞–ª–∏—à–∞—é—Ç—å—Å—è –≤ –Ω—å–æ–º—É —É –≤–∏–≥–ª—è–¥—ñ –≥—ñ–¥—Ä–∞—Ç–æ–≤–∞–Ω–∏—Ö –º–æ–ª–µ–∫—É–ª. –á—Ö –Ω–∞–∑–∏–≤–∞—é—Ç—å –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏.
–ù–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ – —Ü–µ —Ä–µ—á–æ–≤–∏–Ω–∏, —è–∫—ñ –Ω–µ –ø—ñ–¥–¥–∞—é—Ç—å—Å—è –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω—ñ–π –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó, —ñ –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ —á–æ–≥–æ —ó—Ö —Ä–æ–∑–ø–ª–∞–≤–∏ —Ç–∞ —Ä–æ–∑—á–∏–Ω–∏ –Ω–µ –ø—Ä–æ–≤–æ–¥—è—Ç—å –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–π —Å—Ç—Ä—É–º.
–î–æ –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ –Ω–∞–ª–µ–∂–∏—Ç—å –±—ñ–ª—å—à—ñ—Å—Ç—å –æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ –¥—ñ–µ—Ç–∏–ª–æ–≤–∏–π –µ—Ñ—ñ—Ä, –±–µ–Ω–∑–µ–Ω, –≥–ª—é–∫–æ–∑–∞, –∫—Ä–æ—Ö–º–∞–ª—å, —Å–∞—Ö–∞—Ä–æ–∑–∞ (–∑–≤–∏—á–∞–π–Ω–∏–π —Ü—É–∫–æ—Ä), –µ—Ç–∏–ª–æ–≤–∏–π —Å–ø–∏—Ä—Ç. –í–∏–Ω—è—Ç–æ–∫ —Å—Ç–∞–Ω–æ–≤–ª—è—Ç—å –æ—Ä–≥–∞–Ω—ñ—á–Ω—ñ –∫–∏—Å–ª–æ—Ç–∏ —ñ –æ—Å–Ω–æ–≤–∏, —ñ —ó—Ö —Å–æ–ª—ñ.
–ú—ñ–∂ –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–º–∏ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—è–º–∏ –º–µ—Ç–∞–ª—ñ–≤ (–ø—Ä–æ–≤—ñ–¥–Ω–∏–∫–∏ –ø–µ—Ä—à–æ–≥–æ —Ä–æ–¥—É), —ñ —Ä–æ–∑–ø–ª–∞–≤—ñ–≤ –∞–±–æ —Ä–æ–∑—á–∏–Ω—ñ–≤ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ (–ø—Ä–æ–≤—ñ–¥–Ω–∏–∫–∏ –¥—Ä—É–≥–æ–≥–æ —Ä–æ–¥—É) —î —ñ—Å—Ç–æ—Ç–Ω—ñ –≤—ñ–¥–º—ñ–Ω–Ω–æ—Å—Ç—ñ.
|
–í–ª–∞—Å—Ç–∏–≤—ñ—Å—Ç—å |
–ú–µ—Ç–∞–ª |
–Ý–æ–∑—á–∏–Ω/—Ä–æ–∑–ø–ª–∞–≤ |
|
–ù–æ—Å—ñ—ó –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–æ–≥–æ –∑–∞—Ä—è–¥—É |
–ï–ª–µ–∫—Ç—Ä–æ–Ω–∏ |
–Ü–æ–Ω–∏ |
|
–ï–ª–µ–∫—Ç—Ä–æ–ø—Ä–æ–≤—ñ–¥–Ω—ñ—Å—Ç—å |
–í—ñ–¥–º—ñ–Ω–Ω–∞ |
–ù–µ–∑–Ω–∞—á–Ω–∞ |
|
–ó–º—ñ–Ω–∞ –µ–ª–µ–∫—Ç—Ä–æ–ø—Ä–æ–≤—ñ–¥–Ω–æ—Å—Ç—ñ –ø—Ä–∏ –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ |
–ó–º–µ–Ω—à—É—î—Ç—å—Å—è |
–ó–±—ñ–ª—å—à—É—î—Ç—å—Å—è |
|
–ü–µ—Ä–µ—Ç–≤–æ—Ä–µ–Ω–Ω—è —Å–ø–æ–ª—É–∫–∏ –ø—Ä–∏ –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—ñ –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–æ–≥–æ —Å—Ç—Ä—É–º—É |
–ù–µ–º–∞—î |
–Ý–æ–∑–∫–ª–∞–¥–∞—î—Ç—å—Å—è |
–Ý—ñ–≤–Ω—è–Ω–Ω—è –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó
–î–ª—è —Å–∫–ª–∞–¥–∞–Ω–Ω—è —Ä—ñ–≤–Ω—è–Ω—å —ñ–æ–Ω–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π, —â–æ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –≤ —Ä–æ–∑—á–∏–Ω—ñ, –Ω–µ–æ–±—Ö—ñ–¥–Ω–æ –≤–º—ñ—Ç–∏ –∑–∞–ø–∏—Å—É–≤–∞—Ç–∏ —Ä—ñ–≤–Ω—è–Ω–Ω—è —ó—Ö –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó.
–î–ª—è —ñ—Å—Ç–∏–Ω–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —Ä—ñ–≤–Ω—è–Ω–Ω—è –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó –≤—ñ–¥–æ–±—Ä–∞–∂–∞—î —Ç—ñ–ª—å–∫–∏ —Ñ–∞–∫—Ç –ø–µ—Ä–µ—Ö–æ–¥—É –∑–≤’—è–∑–∞–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ –∑ –≤—É–∑–ª—ñ–≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ —É –≤—ñ–ª—å–Ω—ñ –≥—ñ–¥—Ä–∞—Ç–æ–≤–∞–Ω—ñ —ñ–æ–Ω–∏ –≤ —Ä–æ–∑—á–∏–Ω—ñ.
–ü—Ä–∏–∫–ª–∞–¥.
–ù–∞—Ç—Ä—ñ–π –≥—ñ–¥—Ä–æ–∫—Å–∏–¥ –¥–∏—Å–æ—Ü—ñ—é—î —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ –¥–æ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
NaOH ‚áÑ Na+ + OH–
–ù–∞—Ç—Ä—ñ–π –≥—ñ–¥—Ä–æ–∫—Å–∏–¥ –ø—Ä–∞–∫—Ç–∏—á–Ω–æ –ø–æ–≤–Ω—ñ—Å—Ç—é –¥–∏—Å–æ—Ü—ñ—é—î –Ω–∞ —ñ–æ–Ω–∏ —ñ –≤ –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ (–º–∞—é—Ç—å—Å—è –Ω–∞ —É–≤–∞–∑—ñ —Ä–æ–∑–±–∞–≤–ª–µ–Ω—ñ <0,1M —Ä–æ–∑—á–∏–Ω–∏ —ñ—Å—Ç–∏–Ω–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤, —Ç–æ–º—É —â–æ –≤ –±—ñ–ª—å—à –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–æ–≤–∞–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö –ø—Ä–∏—Å—É—Ç–Ω—ñ —Ç–∞–∫–æ–∂ –∫–≤–∞–∑—ñ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ñ —ñ–æ–Ω–Ω—ñ –ø–∞—Ä–∏ —Ç–∏–ø—É Na+Cl– —ñ –±—ñ–ª—å—à —Å–∫–ª–∞–¥–Ω—ñ –∞—Å–æ—Ü—ñ–∞—Ç–∏ – —Ç—Ä—ñ–π–Ω–∏–∫–∏, –∫–≤–∞–¥—Ä—É–ø–æ–ª—ñ) –≤—ñ–Ω –∑–Ω–∞—Ö–æ–¥–∏—Ç—å—Å—è –≤–∏–∫–ª—é—á–Ω–æ —É –≤–∏–≥–ª—è–¥—ñ —ñ–æ–Ω—ñ–≤ Na+ —ñ OH–.
–î–ª—è –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —Ä—ñ–≤–Ω—è–Ω–Ω—è –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó –≤—ñ–¥–æ–±—Ä–∞–∂–∞—î —Ñ–∞–∫—Ç —Ä–æ–∑—Ä–∏–≤—É –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –≤ —ó—Ö –º–æ–ª–µ–∫—É–ª–∞—Ö. –Ø–∫—â–æ —Ç–∞–∫–∏–π —Ä–æ–∑—Ä–∏–≤ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –ø–æ–≤–Ω—ñ—Å—Ç—é –¥–ª—è –≤—Å—ñ—Ö —Ä–æ–∑—á–∏–Ω–µ–Ω–∏—Ö –º–æ–ª–µ–∫—É–ª (—Ç–æ–±—Ç–æ –º–æ–ª–µ–∫—É–ª —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –Ω–µ —ñ—Å–Ω—É—î), —Ç–æ —Ä—ñ–≤–Ω—è–Ω–Ω—è –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó –∑–∞–ø–∏—Å—É—î—Ç—å—Å—è –∞–Ω–∞–ª–æ–≥—ñ—á–Ω–æ —Ä—ñ–≤–Ω—è–Ω–Ω—é –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —Å–ø—Ä–∞–≤–∂–Ω—ñ—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤.
–ü—Ä–∏–∫–ª–∞–¥.
–ì—ñ–¥—Ä–æ–≥–µ–Ω—Ö–ª–æ—Ä–∏–¥ –º–∞—î —Å–∏–ª—å–Ω–æ –ø–æ–ª—è—Ä–Ω–∏–π (–∞–ª–µ –Ω–µ —ñ–æ–Ω–Ω–∏–π –∑–≤’—è–∑–æ–∫), —Ç–æ–º—É –≤—ñ–Ω –≤—ñ–¥–Ω–æ—Å–∏—Ç—å—Å—è –¥–æ –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤. –Ý–æ–∑—á–∏–Ω–µ–Ω–∏–π –≥—ñ–¥—Ä–æ–≥–µ–Ω—Ö–ª–æ—Ä–∏–¥ –¥–∏—Å–æ—Ü—ñ—é—î —É –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ—Å—Ç—ñ –∑ –Ω–∞—Å—Ç—É–ø–Ω–∏–º —Ä—ñ–≤–Ω—è–Ω–Ω—è–º:
HCl ‚áÑ H+ + Cl–; H+ + H2O ‚áÑ H3O+
–£ —Ä–æ–∑–±–∞–≤–ª–µ–Ω–∏—Ö (<0.1M) –≤–æ–¥–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö –≥—ñ–¥—Ä–æ–≥–µ–Ω—Ö–ª–æ—Ä–∏–¥ –¥–∏—Å–æ—Ü—ñ—é—î –Ω–∞ —ñ–æ–Ω–∏ –ø—Ä–∞–∫—Ç–∏—á–Ω–æ –ø–æ–≤–Ω—ñ—Å—Ç—é.
–í —Ä—ñ–≤–Ω—è–Ω–Ω—è—Ö –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —Å–ª—ñ–¥ –≤—Ä–∞—Ö–æ–≤—É–≤–∞—Ç–∏ —Å–∫–ª–∞–¥ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —ñ –≤–∫–∞–∑—É–≤–∞—Ç–∏ —Å—Ç–µ—Ö—ñ–æ–º–µ—Ç—Ä–∏—á–Ω—ñ –∫–æ–µ—Ñ—ñ—Ü—ñ—î–Ω—Ç–∏ –ø–µ—Ä–µ–¥ —Ñ–æ—Ä–º—É–ª–∞–º–∏ —ñ–æ–Ω—ñ–≤.
–ü—Ä–∏–∫–ª–∞–¥.
Al2(SO4)3 ⇄ 2Al3+ + 3SO42-
–¶–µ–π –∑–∞–ø–∏—Å –æ–∑–Ω–∞—á–∞—î, —â–æ –æ–¥–Ω–∞ —Ñ–æ—Ä–º—É–ª—å–Ω–∞ –æ–¥–∏–Ω–∏—Ü—è –∞–º–æ–Ω—ñ–π —Å—É–ª—å—Ñ–∞—Ç—É —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ —Ä–æ–∑–ø–∞–¥–∞—î—Ç—å—Å—è –Ω–∞ –¥–≤–∞ –∫–∞—Ç—ñ–æ–Ω–∞ –∞–ª—é–º—ñ–Ω—ñ—é Al3+ —ñ —Ç—Ä–∏ –∞–Ω—ñ–æ–Ω–∞ —Å—É–ª—å—Ñ–∞—Ç-—ñ–æ–Ω–∞ SO42-.










