ą®ąŠ čéą░ą║ąĄ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘ? ą¦ąĖą╝ ą▓č¢ą┤čĆč¢ąĘąĮčÅčöčéčīčüčÅ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ą▓č¢ą┤ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆą░?
ą¤čĆąĖ ą┐čĆąŠčģąŠą┤ąČąĄąĮąĮč¢ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā č湥čĆąĄąĘ ą╝ąĄčéą░ą╗ąĖ (ą┐čĆąŠą▓č¢ą┤ąĮąĖą║ąĖ I čĆąŠą┤čā) ą▓ąŠąĮąĖ ąĘą░ą╗ąĖčłą░čÄčéčīčüčÅ ąĮąĄąĘą╝č¢ąĮąĮąĖą╝ąĖ. ą¤čĆąĖ ą┐čĆąŠčģąŠą┤ąČąĄąĮąĮč¢ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā č湥čĆąĄąĘ čĆąŠąĘą┐ą╗ą░ą▓ąĖ ą░ą▒ąŠ čĆąŠąĘčćąĖąĮąĖ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéč¢ą▓ (ą┐čĆąŠą▓č¢ą┤ąĮąĖą║ąĖ II čĆąŠą┤čā) ąĮą░ ąĄą╗ąĄą║čéčĆąŠą┤ą░čģ ą┐čĆąŠčéč¢ą║ą░čÄčéčī ą┐čĆąŠčåąĄčüąĖ ą┐ąĄčĆąĄčéą▓ąŠčĆąĄąĮąĮčÅ ąŠą┤ąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ ą▓ č¢ąĮčłč¢.
ą¤čĆąĖ ą┐čĆąŠčģąŠą┤ąČąĄąĮąĮč¢ ą┐ąŠčüčéč¢ą╣ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā č湥čĆąĄąĘ čĆąŠąĘą┐ą╗ą░ą▓ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā ą║ą░čéč¢ąŠąĮąĖ ą┐ąĄčĆąĄą╝č¢čēčāčÄčéčīčüčÅ ą┤ąŠ ąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą┤ą░ (ą║ą░č鹊ą┤ą░) č¢ čĆąŠąĘčĆčÅą┤ąČą░čÄčéčīčüčÅ ąĮą░ ąĄą╗ąĄą║čéčĆąŠą┤č¢, ą░ąĮč¢ąŠąĮąĖ ą┐ąĄčĆąĄą╝č¢čēčāčÄčéčīčüčÅ ą┤ąŠ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą┤ą░ (ą░ąĮąŠą┤ą░) č¢ čĆąŠąĘčĆčÅą┤ąČą░čÄčéčīčüčÅ ąĮą░ ąĄą╗ąĄą║čéčĆąŠą┤č¢
ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ čåąĖčģ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮąĖčģ ą┐čĆąŠčåąĄčüč¢ą▓ ąĄą╗ąĄą║čéčĆąŠą╗č¢čé čĆąŠąĘą║ą╗ą░ą┤ą░čöčéčīčüčÅ (ą╝ąŠąČąĄ ą▓č¢ą┤ą▒čāą▓ą░čéąĖčüčÅ čĆčāą╣ąĮčāą▓ą░ąĮąĮčÅ ą░ąĮąŠą┤ą░). ąóą░ą║ąĖą╣ ą┐čĆąŠčåąĄčü ąĮą░ąĘąĖą▓ą░čÄčéčī ąĢą╗ąĄą║čéčĆąŠą╗č¢ąĘ.
ąĢą╗ąĄą║čéčĆąŠą╗č¢ąĘ – čåąĄ čĆąŠąĘą║ą╗ą░ą┤ą░ąĮąĮčÅ čģč¢ą╝č¢čćąĮąŠčŚ čüą┐ąŠą╗čāą║ąĖ ą┐č¢ą┤ ą┤č¢čöčÄ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā, čēąŠ čüčāą┐čĆąŠą▓ąŠą┤ąČčāčöčéčīčüčÅ čĆąŠąĘčĆčÅą┤ąŠą╝ č¢ąŠąĮč¢ą▓
ą¤čĆąĖ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘč¢ čüą╗č¢ą┤ čĆąŠąĘčĆč¢ąĘąĮčÅčéąĖ ą┤ą▓ą░ ą┐ą░čĆą░ą╗ąĄą╗čīąĮąĖčģ ąĮą░ą┐č¢ą▓ą┐čĆąŠčåąĄčüąĖ:
- ąØą░ ą║ą░č鹊ą┤č¢ č¢ąŠąĮąĖ, čÅą║č¢ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ čĆąŠąĘą┐ą╗ą░ą▓č¢ ą░ą▒ąŠ ą▓ čĆąŠąĘčćąĖąĮč¢ ąŠčéčĆąĖą╝čāčÄčéčī ąĄą╗ąĄą║čéčĆąŠąĮąĖ, č鹊ą▒č鹊 ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ č¢ąŠąĮč¢ą▓;
- ąØą░ ą░ąĮąŠą┤č¢ č¢ąŠąĮąĖ, čÅą║č¢ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ čĆąŠąĘą┐ą╗ą░ą▓č¢ ą░ą▒ąŠ ą▓ čĆąŠąĘčćąĖąĮč¢ ą▓č¢ą┤ą┤ą░čÄčéčī ąĄą╗ąĄą║čéčĆąŠąĮąĖ, č鹊ą▒č鹊 ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ąŠąĮč¢ą▓.
ą¤čĆąĖą║ą╗ą░ą┤.
ąÆ čĆąŠąĘą┐ą╗ą░ą▓č¢ ąĮą░čéčĆč¢ą╣ čģą╗ąŠčĆąĖą┤čā ą┐čĆąĖ ą┐čĆąŠčģąŠą┤ąČąĄąĮąĮč¢ č湥čĆąĄąĘ ąĮčīąŠą│ąŠ ą┐ąŠčüčéč¢ą╣ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā ą┐čĆąŠčéč¢ą║ą░čÄčéčī ąĮą░čüčéčāą┐ąĮč¢ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ. ąØą░ ą║ą░č鹊ą┤č¢ čĆąŠąĘčĆčÅą┤ąČą░čÄčéčīčüčÅ (ą▓č¢ą┤ąĮąŠą▓ą╗čÄčÄčéčīčüčÅ) č¢ąŠąĮąĖ NaŌĆŗŌĆŗ+, ą░ ąĮą░ ą░ąĮąŠą┤č¢ čĆąŠąĘčĆčÅą┤ąČą░čÄčéčīčüčÅ (ąŠą║ąĖčüąĮčÄčÄčéčīčüčÅ) č¢ąŠąĮąĖ Cl-:
NaCl = Na+ + Cl–
ąÜą░č鹊ą┤: Na+ + e– = Na0 (ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ)
ąÉąĮąŠą┤: Cl– – e– = Cl0 (ąŠą║ąĖčüąĮąĄąĮąĮčÅ)
2Cl0 = Cl2 (čāčéą▓ąŠčĆąĄąĮąĮčÅ ą╝ąŠą╗ąĄą║čāą╗)
ąŚą░ą│ą░ą╗čīąĮąĄ čĆč¢ą▓ąĮčÅąĮąĮčÅ ą┐čĆąŠčåąĄčüčā, čēąŠ ą┐čĆąŠčéč¢ą║ą░čö ą▓ čĆąŠąĘą┐ą╗ą░ą▓č¢ NaCl ą┐č¢ą┤ ą┤č¢čöčÄ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā:
2NaCl ŌåÆ 2Na + Cl2
ąĢą╗ąĄą║čéčĆąŠą╗č¢ąĘ – čåąĄ ąŠą║ąĖčüąĮąŠ-ą▓č¢ą┤ąĮąŠą▓ąĮąĖą╣ ą┐čĆąŠčåąĄčü, ą┐čĆąĖ čÅą║ąŠą╝čā ąĮą░ą┐č¢ą▓-ą┐čĆąŠčåąĄčüąĖ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą▓č¢ą┤ąŠą║čĆąĄą╝ą╗ąĄąĮč¢ ąŠą┤ąĖąĮ ą▓č¢ą┤ ąŠą┤ąĮąŠą│ąŠ ą▓ ą┐čĆąŠčüč鹊čĆč¢
ąØą░ą┐č¢ą▓-ą┐čĆąŠčåąĄčüąĖ, čÅą║č¢ ą▓č¢ą┤ą▒čāą▓ą░čÄčéčīčüčÅ ą┐čĆąĖ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘč¢, ąĮą░ąĘąĖą▓ą░čÄčéčī: ą░ąĮąŠą┤ąĮąĄ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ ą║ą░č鹊ą┤ąĮąĄ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ.
ą¤čĆąĖąĮčåąĖą┐ąŠą▓ą░ ą▓č¢ą┤ą╝č¢ąĮąĮč¢čüčéčī čā ą┤č¢čŚ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ č¢ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆą░ ą┐ąŠą╗čÅą│ą░čö ą▓ č鹊ą╝čā, čēąŠ ą┐čĆąŠčåąĄčüąĖ, čÅą║č¢ ą▓č¢ą┤ą▒čāą▓ą░čÄčéčīčüčÅ ą▓ ąĮąĖčģ, ą╝ą░čÄčéčī ą┐čĆąŠčéąĖą╗ąĄąČąĮč¢ ąĮą░ą┐čĆčÅą╝ą║ąĖ.
ąōą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé – ą┤ąČąĄčĆąĄą╗ąŠ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā;
ąĢą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆ – čüą┐ąŠąČąĖą▓ą░čć ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā.
ąÆ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢ čģč¢ą╝č¢čćąĮą░ ąĄąĮąĄčĆą│č¢čÅ ą┐ąĄčĆąĄčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓ ąĄą╗ąĄą║čéčĆąĖčćąĮčā; čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ čĆąĄč湊ą▓ąĖąĮąĖ ą╝ąĄąĮčł ąĄąĮąĄčĆą│ąŠčöą╝ąĮč¢, ąĮč¢ąČ ą▓ąĖčģč¢ą┤ąĮč¢.
ąÆ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆč¢, ąĮą░ą▓ą┐ą░ą║ąĖ, ąĄą╗ąĄą║čéčĆąĖčćąĮą░ ąĄąĮąĄčĆą│č¢čÅ ą┐ąĄčĆąĄčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓ čģč¢ą╝č¢čćąĮčā; čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ čĆąĄč湊ą▓ąĖąĮąĖ ą▒č¢ą╗čīčł ąĄąĮąĄčĆą│ąŠčöą╝ąĮč¢, ąĮč¢ąČ ą▓ąĖčģč¢ą┤ąĮč¢.
ąÆ ąĘą░ą╝ą║ąĮąĄąĮąŠą╝čā ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ą╗ą░ąĮčåčÄąĘč¢ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą┐čĆąŠčéč¢ą║ą░čÄčéčī čüą░ą╝ąŠą┤ąŠą▓č¢ą╗čīąĮąŠ.
ąÆ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆč¢ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą╣ą┤čāčéčī čéč¢ą╗čīą║ąĖ ą┐č¢ą┤ ąĘąŠą▓ąĮč¢čłąĮč¢ą╝ ą▓ą┐ą╗ąĖą▓ąŠą╝ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā, č鹊ą▒č鹊 čüą░ą╝ąŠą┤ąŠą▓č¢ą╗čīąĮąŠ čåč¢ ą┐čĆąŠčåąĄčüąĖ ąĮąĄ ą┐čĆąŠčéč¢ą║ą░čÄčéčī.
ąÆ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ – ą░ąĮąŠą┤, ą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ – ą║ą░č鹊ą┤
ąÆ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆč¢ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ – ą║ą░č鹊ą┤, ą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ – ą░ąĮąŠą┤
ąÆ ąĘą░ą│ą░ą╗čīąĮąŠą╝čā ą▓ąĖą┐ą░ą┤ą║čā ąĮą░ąĘą▓ą░ ąĄą╗ąĄą║čéčĆąŠą┤ą░ ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ ąĮą░ąĘą▓ąŠčÄ čćą░čüčéą║ąĖ. ą»ą║čēąŠ ąĄą╗ąĄą║čéčĆąŠą┤ ą▓č¢ą┤ą┤ą░čö (ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé) ą░ą▒ąŠ ą┐čĆąĖčéčÅą│čāčö (ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆ) ą┐ąŠąĘąĖčéąĖą▓ąĮąŠ ąĘą░čĆčÅą┤ąČąĄąĮč¢ čćą░čüčéąĖąĮą║ąĖ ą║ą░čéč¢ąŠąĮąĖ, č鹊 čéą░ą║ąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ ąĮą░ąĘąĖą▓ą░čÄčéčī ąÜą░č鹊ą┤. ą»ą║čēąŠ ąĄą╗ąĄą║čéčĆąŠą┤ ą▓č¢ą┤ą┤ą░čö (ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé) ą░ą▒ąŠ ą┐čĆąĖčéčÅą│čāčö (ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆ) ąĮąĄą│ą░čéąĖą▓ąĮąŠ ąĘą░čĆčÅą┤ąČąĄąĮč¢ čćą░čüčéąĖąĮą║ąĖ ą░ąĮč¢ąŠąĮąĖ, č鹊 čéą░ą║ąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤ ąĮą░ąĘąĖą▓ą░čÄčéčī ąÉąĮąŠą┤.
ą¤ąŠąĘąĮą░č湥ąĮąĮčÅ “ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣” č¢ “ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣” ąĘą░ą▓ąČą┤ąĖ čüč鹊čüčāčöčéčīčüčÅ ą┐ąŠą╗čÄčüč¢ą▓ ą┤ąČąĄčĆąĄą╗ą░ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā: čüč鹊čüąŠą▓ąĮąŠ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆč¢ą▓ ą┐č¢ą┤ ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╝ č¢ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ąĄą╗ąĄą║čéčĆąŠą┤ą░ą╝ąĖ čĆąŠąĘčāą╝č¢čÄčéčī ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮč¢ ą┐ąŠą╗čÄčüą░ ą┤ąČąĄčĆąĄą╗ą░ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā, ą┤ąŠ čÅą║ąĖčģ ą┐č¢ą┤ą║ą╗čÄč湥ąĮč¢ ąĄą╗ąĄą║čéčĆąŠą┤ąĖ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆą░.
ąå ą▓ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢, č¢ ą▓ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆč¢ ąĮą░ ąĮąĄą│ą░čéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ąĮą░ą┤ą╗ąĖčłąŠą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, ąĮą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ąĮąĄčüčéą░čćą░ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ąóąĄčĆą╝č¢ąĮąĖ “ą║ą░č鹊ą┤” č¢ “ą░ąĮąŠą┤” ą┐ąŠą▓’čÅąĘą░ąĮč¢ čéč¢ą╗čīą║ąĖ ąĘ ąĮą░ą┐čĆčÅą╝ą║ąŠą╝ ą┐ąŠč鹊ą║čā ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ č湥čĆąĄąĘ ąĄą╗ąĄą║čéčĆąŠą┤ąĖ, čÅą║č¢ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčéčī čüąŠą▒ąŠčÄ ą╝ą░č鹥čĆč¢ą░ą╗ąĖ ąĘ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčÄ ą┐čĆąŠą▓č¢ą┤ąĮč¢čüčéčÄ č¢ ąĮą░ ą┐ąŠą▓ąĄčĆčģąĮč¢ čÅą║ąĖčģ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐ąĄčĆąĄčģč¢ą┤ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā ą▓č¢ą┤ ą┐čĆąŠą▓č¢ą┤ąĮąĖą║ą░ I čĆąŠą┤čā (ą╝ąĄčéą░ą╗čā) ą┤ąŠ ą┐čĆąŠą▓č¢ą┤ąĮąĖą║ą░ II čĆąŠą┤čā (ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā).
ąÜą░č鹊ą┤ – čåąĄ ąĄą╗ąĄą║čéčĆąŠą┤, č湥čĆąĄąĘ čÅą║ąĖą╣ ą┐ąŠčéč¢ą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą▓čģąŠą┤ąĖčéčī ą▓ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ą░ą▒ąŠ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆ č¢ ąĮą░ čÅą║ąŠą╝čā ą▓č¢ą┤ą▒čāą▓ą░čÄčéčīčüčÅ ą┐čĆąŠčåąĄčüąĖ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ č湥čĆąĄąĘ ąĮą░čÅą▓ąĮč¢čüčéčī ąĮą░ą┤ą╗ąĖčłą║čā ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ąÉąĮąŠą┤ – čåąĄ ąĄą╗ąĄą║čéčĆąŠą┤, č湥čĆąĄąĘ čÅą║ąĖą╣ ą┐ąŠčéč¢ą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą▓ąĖčģąŠą┤ąĖčéčī ąĘ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ ą░ą▒ąŠ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĄčĆą░ č¢ ąĮą░ čÅą║ąŠą╝čā ą▓č¢ą┤ą▒čāą▓ą░čÄčéčīčüčÅ ą┐čĆąŠčåąĄčüąĖ ąŠą║ąĖčüąĮąĄąĮąĮčÅ ą▓ąĮą░čüą╗č¢ą┤ąŠą║ ąĮąĄčüčéą░čćč¢ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ąÆ ąĄą╗ąĄą║čéčĆąŠą╗č¢ąĘąĮč¢ą╣ ą║ąŠą╝č¢čĆčåč¢ ąĮą░ ąĮąĄą│ą░čéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ – ą║ą░č鹊ą┤č¢ ą┐čĆąŠčéč¢ą║ą░čö ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ, ą░ ąĮą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ – ą░ąĮąŠą┤č¢ – ąŠą║ąĖčüąĮąĄąĮąĮčÅ:
ąÜą░č鹊ą┤: Na+ + e– = Na
ąÉąĮąŠą┤: 2Cl– – 2e– = Cl2
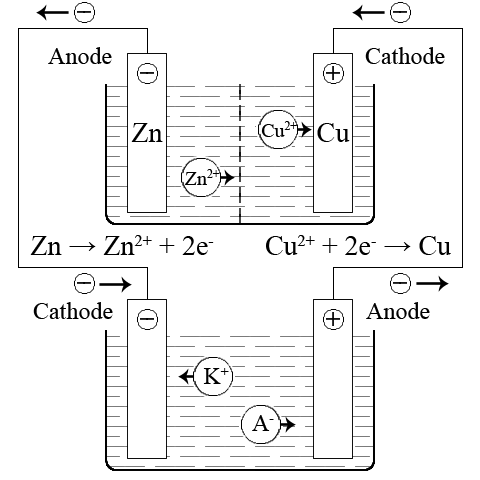
ąÆ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢ ąĮą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ – ą║ą░č鹊ą┤č¢ ą┐čĆąŠčéč¢ą║ą░čö ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ, ą░ ąĮą░ ąĮąĄą│ą░čéąĖą▓ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ – ą░ąĮąŠą┤č¢ – ąŠą║ąĖčüąĮąĄąĮąĮčÅ:
ąÜą░č鹊ą┤: Cu2+ + 2e– = Cu
ąÉąĮąŠą┤: Zn – 2e– = Zn2+










