ą£ąĄąČą┤čā ą║ąŠą╗ąĖč湥čüčéą▓ąŠą╝ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ą┐ąŠčéčĆąĄą▒ą╗čÅąĄą╝čŗą╝ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ, ąĖ ą╝ą░čüčüąŠą╣ ą▓ąĄčēąĄčüčéą▓ą░, ą▓čŗą┤ąĄą╗čÅąĄą╝ąŠą│ąŠ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ąĄ, čüčāčēąĄčüčéą▓čāąĄčé ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī, ąŠčéą║čĆčŗčéą░čÅ ą▓ 1833 ą│ąŠą┤čā ą░ąĮą│ą╗ąĖą╣čüą║ąĖą╝ čäąĖąĘąĖą║ąŠą╝ ążą░čĆą░ą┤ąĄąĄą╝.
ą¤ąĄčĆą▓čŗą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ
ą£ą░čüčüą░ ą▓ąĄčēąĄčüčéą▓ą░, ą▓čŗą┤ąĄą╗ąĖą▓čłąĄą│ąŠčüčÅ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ąĄ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ, ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮą░ ą║ąŠą╗ąĖč湥čüčéą▓čā 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ą┐čĆąŠčłąĄą┤čłąĄą│ąŠ č湥čĆąĄąĘ 菹╗ąĄą║čéčĆąŠą╗ąĖčé:
m = ąÉąĄ * q
ą│ą┤ąĄ m – ą╝ą░čüčüą░ ą▓ąĄčēąĄčüčéą▓ą░, ą│.; ąÉe – ą║ąŠčŹčäčäąĖčåąĖąĄąĮčé ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮąŠčüčéąĖ, ąĮą░ąĘčŗą▓ą░ąĄą╝čŗą╣ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╣ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ą╝ą░čüčüąŠą╣; q – ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░.
ąĢčüą╗ąĖ ą╝ą░čüčüčā ą▓ąĄčēąĄčüčéą▓ą░ ą▓čŗčĆą░ąČą░čéčī ą▓ ą│čĆą░ą╝ą╝ą░čģ (ą│.), ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░ – ą▓ ą║čāą╗ąŠąĮą░čģ (ąÜą╗), č鹊 ąĄą┤ąĖąĮąĖčåąĄą╣ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╣ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ą╝ą░čüčüčŗ ąÉe ą▒čāą┤ąĄčé ą│./ąÜą╗.
ą¤ąŠčüą║ąŠą╗čīą║čā ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░ q (ąÜą╗) čÅą▓ą╗čÅąĄčéčüčÅ ą┐čĆąŠąĖąĘą▓ąŠą┤ąĮąŠą╣ čüąĖą╗čŗ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ I (ą░ą╝ą┐ąĄčĆ ąÉ) čü ą┐čĆąŠą┤ąŠą╗ąČąĖč鹥ą╗čīąĮąŠčüčéčīčÄ čŹą╗ąĄą║čéčĆąŠą╗ąĖąĘą░ Žä (čü), č鹊 ąĄčüčéčī q = IŽä, ą┐ąĄčĆą▓čŗą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ ą╝ąŠąČąĮąŠ ą┐čĆąĄą┤čüčéą░ą▓ąĖčéčī ą▓ ą▓ąĖą┤ąĄ:
m = ąÉąĄ * I * Žä
ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ą░čüčüą░ ąÉąĄ ąĄčüčéčī ą║ąŠąĮčüčéą░ąĮčéą░ ą┤ą╗čÅ ą║ą░ąČą┤ąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ą▓ ą║ąŠąĮą║čĆąĄčéąĮąŠą╣ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ.
ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ą░čüčüą░ – čŹč鹊 ąŠčéąĮąŠčłąĄąĮąĖąĄ ą╝ą░čüčüčŗ ą▓ąĄčēąĄčüčéą▓ą░, ą▓čŗą┤ąĄą╗ąĖą▓čłąĄą│ąŠčüčÅ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ, ą║ ąĘą░čéčĆą░č湥ąĮąĮąŠą╝čā ą║ąŠą╗ąĖč湥čüčéą▓čā 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░:
ąÉąĄ = m / q
ą¤čĆąĖą╝ąĄčĆ.
ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ą░čüčüą░ čüąĄčĆąĄą▒čĆą░ čüąŠčüčéą░ą▓ą╗čÅąĄčé 1,11817e-3 ą│./ąÜą╗. ąŁč鹊 ąŠąĘąĮą░čćą░ąĄčé, čćč鹊 ą┐čĆąĖ ą┐čĆąŠą┐čāčüą║ą░ąĮąĖąĖ č湥čĆąĄąĘ čĆą░čüčéą▓ąŠčĆ čüąŠą╗ąĖ, čüąŠą┤ąĄčƹȹ░čēąĖą╣ ąĖąŠąĮčŗ ąÉg+ (ą║ąŠč鹊čĆčŗąĄ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░čÄčéčüčÅ ą┤ąŠ ąÉg0), 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ čüąĖą╗ąŠą╣ 1ąÉ ą┐čĆąŠą┤ąŠą╗ąČąĖč鹥ą╗čīąĮąŠčüčéčīčÄ 1 čü ąĖąĘ čĆą░čüčéą▓ąŠčĆą░ ąĮą░ ą║ą░č鹊ą┤ąĄ ą▓čŗą┤ąĄą╗ąĖčéčüčÅ 1,11817e-3 ą│. čüąĄčĆąĄą▒čĆą░.
(ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ą░čüčüą░ čüąĄčĆąĄą▒čĆą░ čĆą░ąĮąĄąĄ ą┐čĆąĖą╝ąĄąĮčÅą╗ą░čüčī ą┤ą╗čÅ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ ąĄą┤ąĖąĮąĖčåčŗ čüąĖą╗čŗ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ – ą░ą╝ą┐ąĄčĆ).
ążą░čĆą░ą┤ąĄą╣ čāčüčéą░ąĮąŠą▓ąĖą╗ čéą░ą║ąČąĄ ą▓ąĘą░ąĖą╝ąŠčüą▓čÅąĘčī ą╝ąĄąČą┤čā ą║ąŠą╗ąĖč湥čüčéą▓ą░ą╝ąĖ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą▓ąĄčēąĄčüčéą▓, ą║ąŠč鹊čĆčŗąĄ ą▓čŗą┤ąĄą╗čÅčÄčéčüčÅ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ ąĖ ąĘą░čéčĆą░č湥ąĮąĮčŗą╝ ąĮą░ ąĖčģ ąŠčüą░ąČą┤ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ąŠą╝.
ąÆč鹊čĆąŠą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ
ąÜąŠą╗ąĖč湥čüčéą▓ąŠ ą┤ą▓čāčģ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą▓ąĄčēąĄčüčéą▓, ą║ąŠč鹊čĆčŗąĄ ą▓čŗą┤ąĄą╗čÅčÄčéčüčÅ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ ą┐čĆąĖ čĆą░ą▓ąĮąŠą╝ ą║ąŠą╗ąĖč湥čüčéą▓ąĄ ąĘą░čéčĆą░č湥ąĮąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ąŠą▒čĆą░čéąĮąŠ ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮčŗ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗą╝ čćąĖčüą╗ą░ą╝ čŹčéąĖčģ ą▓ąĄčēąĄčüčéą▓:
n(A) / n(B) = z(B) / z(A)
ą│ą┤ąĄ n(A) ąĖ n(B) – ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą▓ąĄčēąĄčüčéą▓ ąÉ ąĖ ąÆ, ą║ąŠč鹊čĆčŗąĄ ą▓čŗą┤ąĄą╗čÅčÄčéčüčÅ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ (ą╝ąŠą╗čī); z(A) ąĖ z(B) – 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗąĄ čćąĖčüą╗ą░ ą▓ąĄčēąĄčüčéą▓ ąÉ ąĖ ąÆ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąĖčģ (ąŠą║ąĖčüą╗ąĖč鹥ą╗čīąĮąŠ-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čīąĮčŗčģ) čĆąĄą░ą║čåąĖčÅčģ.
ą¤čĆąĖą╝ąĄčĆ.
ąöą▓ąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĮčŗąĄ čÅč湥ą╣ą║ąĖ, ą║ąŠč鹊čĆčŗąĄ čüąŠą┤ąĄčƹȹ░čé čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ CuSO4 ąĖ AgNO3, čüąŠąĄą┤ąĖąĮąĄąĮčŗ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ.
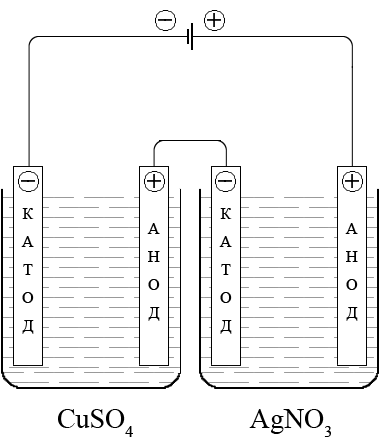
ą¤čĆąĖ ą┐čĆąŠč鹥ą║ą░ąĮąĖąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ąĮą░ ą║ą░č鹊ą┤ą░čģ ą▒čāą┤čāčé čĆą░ąĘčĆčÅąČą░čéčīčüčÅ ąĖąŠąĮčŗ Cu2+ (z = 2) ąĖ Ag+ (z = 1). ąÜąŠą╗ąĖč湥čüčéą▓ąŠ ą╝ąĄą┤ąĖ, ą▓čŗą┤ąĄą╗ąĖą▓čłąĄą╣čüčÅ ą┐čĆąĖ ąĘą░čéčĆą░č湥ąĮąĮąŠą╝ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ąĄ, ą║ąŠč鹊čĆąŠąĄ ąŠčüą░ąČą┤ą░ąĄčé 1 ą╝ąŠą╗čī čüąĄčĆąĄą▒čĆą░, čüąŠčüčéą░ą▓ąĖčé:
n(ąÉg) / n(Cu) = z(Cu2+) / z(ąÉg+)
n(Cu) = n(ąÉg) * z(ąÉg+) / z(ąĪu2+) = 1 * 1/2 = 0,5 ą╝ąŠą╗čī
ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī, ą▓čŗčĆą░ąČąĄąĮąĮą░čÅ ą▓ąŠ ą▓č鹊čĆąŠą╝ ąĘą░ą║ąŠąĮąĄ ążą░čĆą░ą┤ąĄčÅ, čäąĖąĘąĖč湥čüą║ąĖ ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ č鹥ą╝, čćč鹊 1 ą╝ąŠą╗čī (6,022e23) 菹╗ąĄą║čéčĆąŠąĮąŠą▓ čĆą░ąĘčĆčÅąČą░ąĄčé
1 ą╝ąŠą╗čī ąŠą┤ąĮąŠąĘą░čĆčÅą┤ąĮčŗčģ ąĖąŠąĮąŠą▓ (ąÉg+ + e– = ąÉg0)
0,5 ą╝ąŠą╗čī ą┤ą▓čāčģąĘą░čĆčÅą┤ąĮčŗąĄ ąĖąŠąĮąŠą▓ (ąĪu2+ + 2ąĄ– = ąĪu0)
1 / z ą╝ąŠą╗čī z-ąĘą░čĆčÅą┤ąĮčŗčģ ąĖąŠąĮąŠą▓ (ą£z+ + ząĄ– = ą£0)
ą¤čĆą░ą║čéąĖč湥čüą║ąĖ čāą┤ąŠą▒ąĮąĄąĄ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī ą▓č鹊čĆąŠą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ, ąĄčüą╗ąĖ ą▓ą▓ąĄčüčéąĖ ą┐ąŠąĮčÅčéąĖąĄ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮąŠąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą▓ąĄčēąĄčüčéą▓ą░ neq.
ą¤čĆąĖ čĆą░čüčģąŠą┤ąĄ ąŠą┤ąĮąŠą│ąŠ ąĖ č鹊ą│ąŠ ąČąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ ą▓čŗą┤ąĄą╗čÅčÄčéčüčÅ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗąĄ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą▓ąĄčēąĄčüčéą▓:
neq(ąÉ) = neq(ąÆ)
ąÆ čéą░ą║ąŠą╣ č乊čĆą╝čāą╗ąĖčĆąŠą▓ą║ąĄ ą▓č鹊čĆąŠą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ čÅą▓ą╗čÅąĄčéčüčÅ čüą╗ąĄą┤čüčéą▓ąĖąĄą╝ ąĘą░ą║ąŠąĮą░ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮč鹊ą▓ ą┤ą╗čÅ čŹą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣.
ą¤čĆąĖą╝ąĄčĆ.
ąŁą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą▓ąĄčēąĄčüčéą▓ą░ ą╝ąĄą┤ąĖ ąĖ čüąĄčĆąĄą▒čĆą░, ą▓čŗą┤ąĄą╗čÅąĄą╝čŗąĄ ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ (čüą╝ąŠčéčĆąĖč鹥 ą┐čĆąĄą┤čŗą┤čāčēąĖą╣ ą┐čĆąĖą╝ąĄčĆ), ąŠą┤ąĖąĮą░ą║ąŠą▓čŗąĄ ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣:
neq(Ag) = n(Ag) * z(Ag+) = 1 * 1 = 1 ą╝ąŠą╗čī
neq(Cu) = n(Cu) * z(Cu2+) = 0,5 * 2 = 1 ą╝ąŠą╗čī
ąÆč鹊čĆąŠą╣ ąĘą░ą║ąŠąĮ ążą░čĆą░ą┤ąĄčÅ ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą┐ąĄčĆąĄą╣čéąĖ ąŠčé ą║ąŠą╗ąĖč湥čüčéą▓ ą▓ąĄčēąĄčüčéą▓ ą║ ąĖčģ ą╝ą░čüčüą░ą╝ (č湥čĆąĄąĘ ą╝ąŠą╗čÅčĆąĮčŗąĄ ą╝ą░čüčüčŗ):
m(A) m(B) = M(A) / z(ąÉ): M(B) / z(B)
ą¤čĆąĖą╝ąĄčĆ.
ąØčāąČąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī ą╝ą░čüčüčā ą╝ąĄą┤ąĖ, ą▓čŗą┤ąĄą╗ąĖą▓čłčāčÄčüčÅ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ čĆą░čüčéą▓ąŠčĆą░ CuSO4, ąĄčüą╗ąĖ ąĖąĘą▓ąĄčüčéąĮąŠ, čćč鹊 ą▓ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ čüąŠąĄą┤ąĖąĮąĄąĮąĮąŠą╣ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĮąŠą╣ čÅč湥ą╣ą║ąĄ ą┐čĆąĖ ąĘą░čéčĆą░č鹥 ąŠą┤ąĮąŠą│ąŠ ąĖ č鹊ą│ąŠ ąČąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░ ą▓čŗą┤ąĄą╗ąĖą╗ąŠčüčī 0,2157 ą│. čüąĄčĆąĄą▒čĆą░.
ą£ą░čüčüą░ ą╝ąĄą┤ąĖ čüąŠčüčéą░ą▓ąĖčé:
m(Cu) = m(Ag) * (z(Ag+) * M(Cu)) / (z(Cu2+) * M(Ag)) = 0,2157 * ((1 * 63,546) / (2 * 107,868)) = 0,0636 ą│.
ąśčüčģąŠą┤čÅ ąĖąĘ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ą╝ą░čüčüčŗ, čāčĆą░ą▓ąĮąĄąĮąĖčÅ ą▓č鹊čĆąŠą│ąŠ ąĘą░ą║ąŠąĮą░ ążą░čĆą░ą┤ąĄčÅ ą╝ąŠąČąĮąŠ ąĘą░ą┐ąĖčüą░čéčī ą▓ ą▓ąĖą┤ąĄ:
ą£eq = ą£ / z, č鹊ą│ą┤ą░ m(A) / m(B) = Meq(ąÉ) / Meq(ąÆ)
ą£ą░čüčüčŗ ą┤ą▓čāčģ ą▓ąĄčēąĄčüčéą▓, ą║ąŠč鹊čĆčŗąĄ ą▓čŗą┤ąĄą╗čÅčÄčéčüčÅ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ ą┐čĆąĖ ą┐ąŠčéčĆąĄą▒ą╗ąĄąĮąĖąĖ ąŠą┤ąĖąĮą░ą║ąŠą▓ąŠą│ąŠ ą║ąŠą╗ąĖč湥čüčéą▓ą░ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ą┐čĆčÅą╝ąŠ ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮčŗ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗą╝ ą╝ą░čüčüą░ą╝ čŹčéąĖčģ ą▓ąĄčēąĄčüčéą▓
ą¤čĆąĖą╝ąĄčĆ. ąŁą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗąĄ ą╝ą░čüčüčŗ ą╝ąĄą┤ąĖ ąĖ čüąĄčĆąĄą▒čĆą░ čĆą░ą▓ąĮčŗ:
ą£eq(Cu) = M(Cu) / z(Cu2+) = 63,546 / 2 = 31,773 ą│ / ą╝ąŠą╗čī
ą£eq(Ag) = M(Ag) / z(Ag+) = 107,868 / 1 = 107,868 ą│./ą╝ąŠą╗čī
ą×čéąĮąŠčłąĄąĮąĖąĄ ąĖčģ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮčŗčģ ą╝ą░čüčü ąĖ ąŠčéąĮąŠčłąĄąĮąĖąĄ ą╝ą░čüčü čŹčéąĖčģ ą▓ąĄčēąĄčüčéą▓ (čüą╝ąŠčéčĆąĖč鹥 ą┐čĆąĄą┤čŗą┤čāčēąĖą╣ ą┐čĆąĖą╝ąĄčĆ) ą┤ąŠą╗ąČąĮčŗ ą▒čŗčéčī ąŠą┤ąĖąĮą░ą║ąŠą▓čŗ:
ą£eq(Cu) / Meq(Ag) = 31,773 / 107,868 = 0,295
m(Cu) / m(Ag) = 0,0636 / 0,2157 = 0,295
ąśąĘ ąĘą░ą║ąŠąĮąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą╝ąŠąČąĮąŠ čüą┤ąĄą╗ą░čéčī čüą╗ąĄą┤čāčÄčēąĄąĄ ąŠą▒ąŠą▒čēąĄąĮąĖąĄ: ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ąĮąĄąŠą▒čģąŠą┤ąĖą╝ąŠą│ąŠ ą┤ą╗čÅ čĆą░ąĘčĆčÅą┤ą║ąĖ 菹║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮąŠą│ąŠ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą║ą░ą║ąŠą│ąŠ-ą╗ąĖą▒ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ą▓ 1 ą╝ąŠą╗čī, ąŠą┤ąĖąĮą░ą║ąŠą▓ą░; čŹč鹊 ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ 1 ą╝ąŠą╗čī 菹╗ąĄą╝ąĄąĮčéą░čĆąĮčŗčģ 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖčģ ąĘą░čĆčÅą┤ąŠą▓.
ą¤ąŠčüč鹊čÅąĮąĮą░čÅ ążą░čĆą░ą┤ąĄčÅ – čŹč鹊 ą║ąŠą╗ąĖč湥čüčéą▓ąŠ 菹╗ąĄą║čéčĆąĖč湥čüčéą▓ą░, ą║ąŠč鹊čĆčŗą╝ ąŠą▒ą╗ą░ą┤ą░čÄčé 1 ą╝ąŠą╗čī 菹╗ąĄą╝ąĄąĮčéą░čĆąĮčŗčģ 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖčģ ąĘą░čĆčÅą┤ąŠą▓
F = 96484,56 ąÜą╗/ą╝ąŠą╗čī
ą¦ąĖčüą╗ąŠą▓ąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ ą┐ąŠčüč鹊čÅąĮąĮąŠą╣ ążą░čĆą░ą┤ąĄčÅ (F) ąĮą░ąĘčŗą▓ą░čÄčé čćąĖčüą╗ąŠ ążą░čĆą░ą┤ąĄčÅ
F = 96484,56 ąÜą╗/ą╝ąŠą╗čī = 96484,56 ąÉ*čü/ą╝ąŠą╗čī = 26,8 ąÉ*čć./ą£ąŠą╗čī
ą×čéąĮąŠčłąĄąĮąĖąĄ ą┐ąŠčüč鹊čÅąĮąĮąŠą╣ ążą░čĆą░ą┤ąĄčÅ ą║ ą┐ąŠčüč鹊čÅąĮąĮąŠą╣ ąÉą▓ąŠą│ą░ą┤čĆąŠ čüąŠąŠčéą▓ąĄčéčüčéą▓čāąĄčé ąĘąĮą░č湥ąĮąĖčÄ čŹą╗ąĄą╝ąĄąĮčéą░čĆąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ ąĘą░čĆčÅą┤ą░:
F / NA = e– = 96484,56 ąÜą╗ / ą╝ąŠą╗čī / 6,022e23 ą╝ąŠą╗čī-1 = 1,602189 ąÜą╗
ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ čŹą║ą▓ąĖą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ą░čüčüą░ ą▓ąĄčēąĄčüčéą▓ą░ ąÉąĄ ąĘą░ą▓ąĖčüąĖčé ąŠčé 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ ąĖ ąŠą┐čĆąĄą┤ąĄą╗čÅąĄčéčüčÅ ą║ą░ą║ ąŠčéąĮąŠčłąĄąĮąĖąĄ:
ąÉąĄ = ą£ / (zF) = ą£eqIF
ą¤čĆąĖą╝ąĄčĆ.
ąöą╗čÅ ąĖąŠąĮąŠą▓ FąĄ2+ ąĖ FąĄ3+ ą┐čĆąĖ ąĖčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą┤ąŠ FąĄ0 (z = 2 ąĖ 3 čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ) ąĘąĮą░č湥ąĮąĖčÅ ąÉąĄ čüą╗ąĄą┤čāčÄčēąĖąĄ:
ąÉąĄ(FąĄ2+) = M(Fe) / (z(Fe2+) * F) = 55,847 ą│./ą╝ąŠą╗čī / (2*96484,56) = 2,894e-4 ą│./ąÜą╗
ąÉąĄ(FąĄ3+) = M(Fe) / (z(Fe3+) * F) = 55,847 ą│./ą╝ąŠą╗čī / (3*96484,56) = 1,929e-4 ą│./ąÜą╗
ą×ą▒čŖąĄą┤ąĖąĮąĖą▓ ą▓čüąĄ ą┐čĆąĄą┤čŗą┤čāčēąĖąĄ čāčĆą░ą▓ąĮąĄąĮąĖčÅ, ą╝ąŠąČąĮąŠ ąĘą░ą┐ąĖčüą░čéčī:
m = ą£IŽä / (zF)
ąĪ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ čŹč鹊ą│ąŠ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ą┐čĆąŠą▓ąŠą┤čÅčéčüčÅ ą▓čüąĄ čĆą░čüč湥čéčŗ, ąŠčüąĮąŠą▓ą░ąĮąĮčŗąĄ ąĮą░ ąĘą░ą║ąŠąĮą░čģ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░.










