Положення хімічної рівноваги залежить від наступних параметрів хімічної реакції: температури, тиску і концентрації речовин. Вплив зазначених факторів на рівновагу оборотної хімічної реакції, має закономірність, яка в загальному вигляді була сформульована в 1884 році французьким фізико-хіміком Ле Шательє; підтверджена в тому ж році голландським фізико-хіміком Вант-Гоффом і в 1887 році термодинамічно обгрунтована німецьким фізиком Брауном. Повна назва цієї закономірності принцип Ле Шательє-Вант Гоффа-Брауна, або скорочено – принцип Ле Шательє. Принцип Ле Шательє має і інші назви: принцип рухомої рівноваги та принцип зміщення рівноваги.
Принцип Ле Шательє: Якщо на систему, що знаходиться в стані рівноваги, вплинути ззовні, то система змінює стан рівноваги таким чином, щоб зменшити ефект зовнішнього впливу
Тобто, рівноважна хімічна система здатна нівелювати вплив зміни зовнішніх умов.
Принцип Ле Шательє стосується зміщення стану динамічної хімічної рівноваги.
Вплив температури на зміщення хімічної рівноваги
Всі хімічні реакції протікають зі зміною ентальпії. В кожній оборотній реакції один з її напрямків є екзотермічним процесом, а інший – ендотермічним.
Приклад.
В реакції синтезу амоніаку
N2 (газ) + 3H2 (газ) ⇄ 2NH3; ΔH0 = -92 кДж
пряма реакція є екзотермічною, а зворотна реакція – ендотермічна.
При підвищенні температури хімічна рівновага зміщується в напрямку ендотермічної реакції
При зниженні температури хімічна рівновага зміщується в напрямку екзотермічної реакції
Будь-яка ендотермічна реакція поглинає теплову енергію (кінетична енергія перетворюється в хімічну енергію). Реакційна система змінює свій початковий рівноважний стан під впливом теплоти доти, поки не буде досягнуто нового положення рівноважного стану.
Приклад.
В процесі синтезу амоніаку зниження температури сприяє утворенню амоніаку (тобто реакція утворення амоніаку є екзотермічною реакцією). Підвищення температури сприяє оборотній реакції розкладання амоніаку (ендотермічна реакція):
|
t, *C |
300 |
400 |
500 |
600 |
700 |
|
ω%(NH3)об. |
63 |
36 |
18 |
8 |
4 |
Положення рівноваги реакції синтезу амоніаку при відносно низьких температурах (300*С) зміщене в бік утворення NH3, а при відносно високих температурах (700*С) – в бік утворення суміші вихідних речовин H2 і N2.
Вплив тиску на зміщення хімічної рівноваги
Зміна тиску впливає на зміщення хімічної рівноваги всіх хімічних реакцій в яких реагенти і продукти знаходяться в газоподібному стані, і супроводжуються зміною об’єму, якщо змінюється кількість речовин при переході від реагентів до продуктів.
При підвищенні тиску рівновага зміщується в напрямку утворення речовин (реагентів або продуктів), які займають менший об’єм
При зниженні тиску рівновага зміщується в напрямку утворення речовин (реагентів або продуктів), які займають більший об’єм
Тобто, при зміні тиску в реакційній системі розвивається та хімічна реакція (пряма або оборотна), яка послаблює ефект зовнішнього впливу.
Приклад.
При синтезі амоніаку 1 моль азоту і 3 моль водню утворюють 2 моль амоніаку, тобто одна об’ємна частка N2 і три об’ємні частки H2 перетворюються на дві об’ємні частки NH3:
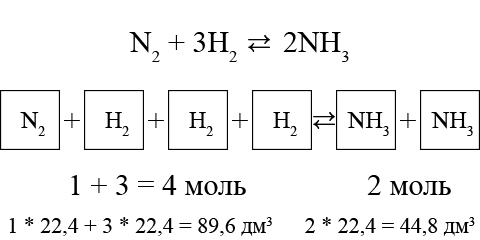
Як бачимо, від реагентів до продуктів об’єм, який займають гази, знижується в два рази. Отже, при підвищенні тиску рівновага системи пропорційно зміщується в бік утворення амоніаку.
|
p, МПа |
0,1 |
10 |
20 |
30 |
60 |
100 |
|
ω%(NH3)об. |
0,40 |
26 |
36 |
46 |
66 |
80 |
При відносно високому тиску (80 МПа) положення рівноваги зміщується в бік утворення NH3, а при відносно низькому тиску – в бік суміші N2 і H2.
Вплив концентрації на зміщення хімічної рівноваги
При підвищенні концентрації одного з реагентів рівновага системи зміщується в бік утворення продуктів реакції
При підвищенні концентрації одного з продуктів рівновага системи зміщується в бік утворення реагентів
Такий вплив проявляється тільки при додаванні в реакційну суміш лише одного реагента або продукта; кількість інших реагентів або продуктів залишаються незмінними і витрачаються в процесі перебігу хімічної реакції доти, поки не буде досягнуто нового стану рівноваги системи.
Приклад.
Контактний метод отримання сульфатної кислоти потребує якомога більш повного перетворення сульфур діоксиду в сульфур триоксид:
2SO2 + O2 ⇄ 2SO3
Збільшити вихід SO3 (шляхом зміни концентрації реагентів) можна:
- Підвищити концентрацію SO2 (не рентабельно і екологічно небезпечно);
- Підвищити концентрацію O2.
В виробництві сульфатної кислоти більшої ступені конверсії SO2 в SO3 досягають при надлишку в системі повітря збагаченого киснем.
В водному розчині купрум(II) хлорида відбувається рівноважна реакція
Cu2+ + 3Cl– ⇄ [CuCl3]–
Рівноважний стан при низькій концентрації Cl– зміщується в бік реагентів – розчин має блакитне забарвлення. Якщо в розчин додати надлишок хлорид-іонів (наприклад, додавши розчин хлоридної кислоти) рівноважний стан зміщується в бік утворення продуктів і забарвлення розчину змінюється на зелене.










