ą¤ąŠą╗ąŠąČąĄąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ ąĘą░ą▓ąĖčüąĖčé ąŠčé čüą╗ąĄą┤čāčÄčēąĖčģ ą┐ą░čĆą░ą╝ąĄčéčĆąŠą▓ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ: č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ, ą┤ą░ą▓ą╗ąĄąĮąĖčÅ ąĖ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą▓ąĄčēąĄčüčéą▓. ąÆą╗ąĖčÅąĮąĖąĄ čāą║ą░ąĘą░ąĮąĮčŗčģ čäą░ą║č鹊čĆąŠą▓ ąĮą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ ąŠą▒čĆą░čéąĖą╝ąŠą╣ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ, ą┐ąŠą┤čćąĖąĮčÅąĄčéčüčÅ ąĘą░ą║ąŠąĮąŠą╝ąĄčĆąĮąŠčüčéąĖ, ą║ąŠč鹊čĆą░čÅ ą▒čŗą╗ą░ ą▓ ąŠą▒čēąĄą╝ ą▓ąĖą┤ąĄ ą▓čŗčüą║ą░ąĘą░ąĮą░ ą▓ 1884 ą│ąŠą┤čā čäčĆą░ąĮčåčāąĘčüą║ąĖą╝ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖą║ąŠą╝ ąøąĄ ą©ą░č鹥ą╗čīąĄ; ą┐ąŠą┤čéą▓ąĄčƹȹ┤ąĄąĮą░ ą▓ č鹊ą╝ ąČąĄ ą│ąŠą┤čā ą│ąŠą╗ą╗ą░ąĮą┤čüą║ąĖą╝ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖą║ąŠą╝ ąÆą░ąĮčé-ąōąŠčäč乊ą╝ ąĖ ą▓ 1887 ą│ąŠą┤čā č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖ ąŠą▒ąŠčüąĮąŠą▓ą░ąĮą░ ąĮąĄą╝ąĄčåą║ąĖą╝ čäąĖąĘąĖą║ąŠą╝ ąæčĆą░čāąĮąŠą╝. ą¤ąŠčŹč鹊ą╝čā ą┐ąŠą╗ąĮąŠąĄ ąĮą░ąĘą▓ą░ąĮąĖąĄ čŹč鹊ą╣ ąĘą░ą║ąŠąĮąŠą╝ąĄčĆąĮąŠčüčéąĖ ą┐čĆąĖąĮčåąĖą┐ ąøąĄ ą©ą░č鹥ą╗čīąĄ-ąÆą░ąĮčé ąōąŠčäčäą░-ąæčĆą░čāąĮą░, ąĖą╗ąĖ čüąŠą║čĆą░čēąĄąĮąĮąŠ – ą┐čĆąĖąĮčåąĖą┐ ąøąĄ ą©ą░č鹥ą╗čīąĄ. ą¤čĆąĖąĮčåąĖą┐ ąøąĄ ą©ą░č鹥ą╗čīąĄ ąĖą╝ąĄąĄčé ąĖ ą┤čĆčāą│ąĖąĄ ąĮą░ąĘą▓ą░ąĮąĖčÅ: ą┐čĆąĖąĮčåąĖą┐ ą┐ąŠą┤ą▓ąĖąČąĮąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ ąĖ ą┐čĆąĖąĮčåąĖą┐ čüą╝ąĄčēąĄąĮąĖčÅ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ.
ą¤čĆąĖąĮčåąĖą┐ ąøąĄ ą©ą░č鹥ą╗čīąĄ: ąĄčüą╗ąĖ ąĮą░ čüąĖčüč鹥ą╝čā, ąĮą░čģąŠą┤čÅčēčāčÄčüčÅ ą▓ čüąŠčüč鹊čÅąĮąĖąĖ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ, ąŠą║ą░ąĘą░čéčī ą▓ąĮąĄčłąĮąĄąĄ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖąĄ, č鹊 čüąĖčüč鹥ą╝ą░ ąĖąĘą╝ąĄąĮčÅąĄčé čüąŠčüč鹊čÅąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čéą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, čćč鹊ą▒čŗ čāą╝ąĄąĮčīčłąĖčéčī čŹčäč乥ą║čé ą▓ąĮąĄčłąĮąĄą│ąŠ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖčÅ
ąóąŠ ąĄčüčéčī, čĆą░ą▓ąĮąŠą▓ąĄčüąĮą░čÅ čģąĖą╝ąĖč湥čüą║ą░čÅ čüąĖčüč鹥ą╝ą░ čüą┐ąŠčüąŠą▒ąĮą░ ąĮąĖą▓ąĄą╗ąĖčĆąŠą▓ą░čéčī ą▓ą╗ąĖčÅąĮąĖąĄ ąĖąĘą╝ąĄąĮąĄąĮąĖčÅ ą▓ąĮąĄčłąĮąĖčģ čāčüą╗ąŠą▓ąĖą╣.
ą¤čĆąĖąĮčåąĖą┐ ąøąĄ ą©ą░č鹥ą╗čīąĄ ą║ą░čüą░ąĄčéčüčÅ čüą╝ąĄčēąĄąĮąĖčÅ čüąŠčüč鹊čÅąĮąĖčÅ ą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ.
ąÆą╗ąĖčÅąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĮą░ čüą╝ąĄčēąĄąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ
ąÆčüąĄ čģąĖą╝ąĖč湥čüą║ąĖąĄ čĆąĄą░ą║čåąĖąĖ ą┐čĆąŠč鹥ą║ą░čÄčé čü ąĖąĘą╝ąĄąĮąĄąĮąĖąĄą╝ 菹Įčéą░ą╗čīą┐ąĖąĖ. ąÆ ą║ą░ąČą┤ąŠą╣ ąŠą▒čĆą░čéąĖą╝ąŠą╣ čĆąĄą░ą║čåąĖąĖ ąŠą┤ąĮąŠ ąĖąĘ ąĄąĄ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖą╣ čÅą▓ą╗čÅąĄčéčüčÅ čŹą║ąĘąŠč鹥čĆą╝ąĖč湥čüą║ąĖą╝ ą┐čĆąŠčåąĄčüčüąŠą╝, ą░ ą┤čĆčāą│ąŠąĄ – 菹Įą┤ąŠč鹥čĆą╝ąĖč湥čüą║ąĖą╝.
ą¤čĆąĖą╝ąĄčĆ.
ąÆ čĆąĄą░ą║čåąĖąĖ čüąĖąĮč鹥ąĘą░ ą░ą╝ą╝ąĖą░ą║ą░
N2 (ą│ą░ąĘ) + 3H2 (ą│ą░ąĘ) Ōćä 2NH3; ╬öH0 = -92 ą║ąöąČ
ą┐čĆčÅą╝ą░čÅ čĆąĄą░ą║čåąĖčÅ čÅą▓ą╗čÅąĄčéčüčÅ čŹą║ąĘąŠč鹥čĆą╝ąĖč湥čüą║ąŠą╣, ą░ ąŠą▒čĆą░čéąĮą░čÅ čĆąĄą░ą║čåąĖčÅ – 菹Įą┤ąŠč鹥čĆą╝ąĖč湥čüą║ą░čÅ.
ą¤čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čģąĖą╝ąĖč湥čüą║ąŠąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĖ 菹Įą┤ąŠč鹥čĆą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ
ą¤čĆąĖ ą┐ąŠąĮąĖąČąĄąĮąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čģąĖą╝ąĖč湥čüą║ąŠąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĖ 菹║ąĘąŠč鹥čĆą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ
ąøčÄą▒ą░čÅ čŹąĮą┤ąŠč鹥čĆą╝ąĖč湥čüą║ą░čÅ čĆąĄą░ą║čåąĖčÅ ą┐ąŠą│ą╗ąŠčēą░ąĄčé č鹥ą┐ą╗ąŠą▓čāčÄ čŹąĮąĄčĆą│ąĖčÄ (ą║ąĖąĮąĄčéąĖč湥čüą║ą░čÅ čŹąĮąĄčĆą│ąĖčÅ ą┐čĆąĄą▓čĆą░čēą░ąĄčéčüčÅ ą▓ čģąĖą╝ąĖč湥čüą║čāčÄ čŹąĮąĄčĆą│ąĖčÄ). ąĀąĄą░ą║čåąĖąŠąĮąĮą░čÅ čüąĖčüč鹥ą╝ą░ ą╝ąĄąĮčÅąĄčé čüą▓ąŠąĄ ą┐ąĄčĆą▓ąŠąĮą░čćą░ą╗čīąĮąŠąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠąĄ čüąŠčüč鹊čÅąĮąĖąĄ ą┐ąŠą┤ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖąĄą╝ č鹥ą┐ą╗ąŠčéčŗ, ą┐ąŠą║ą░ ąĮąĄ ą▒čāą┤ąĄčé ą┤ąŠčüčéąĖą│ąĮčāč鹊 ąĮąŠą▓ąŠąĄ ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠą│ąŠ čüąŠčüč鹊čÅąĮąĖčÅ.
ą¤čĆąĖą╝ąĄčĆ.
ąÆ ą┐čĆąŠčåąĄčüčüąĄ čüąĖąĮč鹥ąĘą░ ą░ą╝ą╝ąĖą░ą║ą░ čüąĮąĖąČąĄąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čüą┐ąŠčüąŠą▒čüčéą▓čāąĄčé ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ ą░ą╝ą╝ąĖą░ą║ą░ (č鹊 ąĄčüčéčī čĆąĄą░ą║čåąĖčÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą░ą╝ą╝ąĖą░ą║ą░ čÅą▓ą╗čÅąĄčéčüčÅ čŹą║ąĘąŠč鹥čĆą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĄą╣). ą¤ąŠą▓čŗčłąĄąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čüą┐ąŠčüąŠą▒čüčéą▓čāąĄčé ą┐čĆąŠč鹥ą║ą░ąĮąĖčÄ ąŠą▒čĆą░čéąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ – čĆą░ąĘą╗ąŠąČąĄąĮąĖąĄ ą░ą╝ą╝ąĖą░ą║ą░ (菹Įą┤ąŠč鹥čĆą╝ąĖč湥čüą║ą░čÅ čĆąĄą░ą║čåąĖąĖ):
|
t, *C |
300 |
400 |
500 |
600 |
700 |
|
Žē%(NH3)ąŠą▒. |
63 |
36 |
18 |
8 |
4 |
ą¤ąŠą╗ąŠąČąĄąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čĆąĄą░ą║čåąĖąĖ čüąĖąĮč鹥ąĘą░ ą░ą╝ą╝ąĖą░ą║ą░ ą┐čĆąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąĮąĖąĘą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ (300*ąĪ) čüą╝ąĄčēąĄąĮąŠ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ NH3, ą░ ą┐čĆąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ą▓čŗčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ (700*ąĪ) – ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čüą╝ąĄčüąĖ ąĖčüčģąŠą┤ąĮčŗčģ ą▓ąĄčēąĄčüčéą▓ H2 ąĖ N2.
ąÆą╗ąĖčÅąĮąĖąĄ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ ąĮą░ čüą╝ąĄčēąĄąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ
ąśąĘą╝ąĄąĮąĄąĮąĖąĄ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ ą▓ą╗ąĖčÅąĄčé ąĮą░ čüą╝ąĄčēąĄąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ ą▓čüąĄčģ čģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣, ą▓ ą║ąŠč鹊čĆčŗčģ čĆąĄą░ą│ąĄąĮčéčŗ ąĖ ą┐čĆąŠą┤čāą║čéčŗ ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ, ąĖ ą║ąŠč鹊čĆčŗąĄ čüąŠą┐čĆąŠą▓ąŠąČą┤ą░čÄčéčüčÅ ąĖąĘą╝ąĄąĮąĄąĮąĖąĄą╝ ąŠą▒čŖąĄą╝ą░, ąĄčüą╗ąĖ ąĖąĘą╝ąĄąĮčÅąĄčéčüčÅ ą║ąŠą╗ąĖč湥čüčéą▓ąŠ ą▓ąĄčēąĄčüčéą▓ ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤ąĄ ąŠčé čĆąĄą░ą│ąĄąĮč鹊ą▓ ą║ ą┐čĆąŠą┤čāą║čéą░ą╝.
ą¤čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą▓ąĄčēąĄčüčéą▓ (čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖą╗ąĖ ą┐čĆąŠą┤čāą║č鹊ą▓), ą║ąŠč鹊čĆčŗąĄ ąĘą░ąĮąĖą╝ą░čÄčé ą╝ąĄąĮčīčłąĖą╣ ąŠą▒čŖąĄą╝
ą¤čĆąĖ čüąĮąĖąČąĄąĮąĖąĖ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą▓ąĄčēąĄčüčéą▓ (čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖą╗ąĖ ą┐čĆąŠą┤čāą║č鹊ą▓), ą║ąŠč鹊čĆčŗąĄ ąĘą░ąĮąĖą╝ą░čÄčé ą▒ąŠą╗čīčłąĖą╣ ąŠą▒čŖąĄą╝
ąóąŠ ąĄčüčéčī, ą┐čĆąĖ ąĖąĘą╝ąĄąĮąĄąĮąĖąĖ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ ą▓ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüąĖčüč鹥ą╝ąĄ čĆą░ąĘą▓ąĖą▓ą░ąĄčéčüčÅ čéą░ čģąĖą╝ąĖč湥čüą║ą░čÅ čĆąĄą░ą║čåąĖčÅ (ą┐čĆčÅą╝ą░čÅ ąĖą╗ąĖ ąŠą▒čĆą░čéąĮą░čÅ), ą║ąŠč鹊čĆą░čÅ ąŠčüą╗ą░ą▒ą╗čÅąĄčé čŹčäč乥ą║čé ą▓ąĮąĄčłąĮąĄą│ąŠ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖčÅ.
ą¤čĆąĖą╝ąĄčĆ.
ą¤čĆąĖ čüąĖąĮč鹥ąĘąĄ ą░ą╝ą╝ąĖą░ą║ą░ 1 ą╝ąŠą╗čī ą░ąĘąŠčéą░ ąĖ 3 ą╝ąŠą╗čī ą▓ąŠą┤ąŠčĆąŠą┤ą░ ąŠą▒čĆą░ąĘčāčÄčé 2 ą╝ąŠą╗čī ą░ą╝ą╝ąĖą░ą║ą░, č鹊 ąĄčüčéčī ąŠą┤ąĮą░ ąŠą▒čŖąĄą╝ąĮą░čÅ ą┤ąŠą╗čÅ N2 ąĖ čéčĆąĖ ąŠą▒čŖąĄą╝ąĮčŗąĄ ą┤ąŠą╗ąĖ H2 ą┐čĆąĄąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą▓ ą┤ą▓ąĄ ąŠą▒čŖąĄą╝ąĮčŗąĄ ą┤ąŠą╗ąĖ NH3:
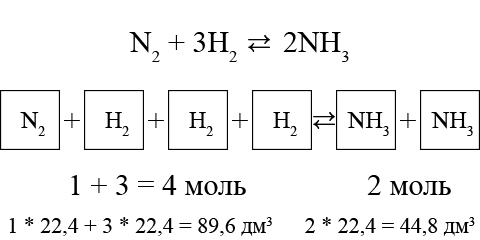
ąÜą░ą║ ą▓ąĖą┤ąĖą╝, ąŠčé čĆąĄą░ą│ąĄąĮč鹊ą▓ ą║ ą┐čĆąŠą┤čāą║čéą░ą╝ ą┐ąĄčĆą▓ąŠąĮą░čćą░ą╗čīąĮčŗą╣ ąŠą▒čŖąĄą╝, ą║ąŠč鹊čĆčŗą╣ ąĘą░ąĮąĖą╝ą░čÄčé ą│ą░ąĘčŗ, čüąĮąĖąČą░ąĄčéčüčÅ ą▓ ą┤ą▓ą░ čĆą░ąĘą░. ąĪą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ, ą┐čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ ą┤ą░ą▓ą╗ąĄąĮąĖčÅ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüąĖčüč鹥ą╝čŗ ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮąŠ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą░ą╝ą╝ąĖą░ą║ą░.
|
p, ą£ą¤ą░ |
0,1 |
10 |
20 |
30 |
60 |
100 |
|
Žē%(NH3)ąŠą▒. |
0,40 |
26 |
36 |
46 |
66 |
80 |
ą¤čĆąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ą▓čŗčüąŠą║ąŠą╝ ą┤ą░ą▓ą╗ąĄąĮąĖąĖ (80 ą£ą¤ą░) ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ NH3, ą░ ą┐čĆąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąĮąĖąĘą║ąŠą╝ ą┤ą░ą▓ą╗ąĄąĮąĖąĖ – ą▓ čüč鹊čĆąŠąĮčā čüą╝ąĄčüąĖ N2 ąĖ H2.
ąÆą╗ąĖčÅąĮąĖąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ąĮą░ čüą╝ąĄčēąĄąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ
ą¤čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ąŠą┤ąĮąŠą│ąŠ ąĖąĘ čĆąĄą░ą│ąĄąĮč鹊ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüąĖčüč鹥ą╝čŗ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆąĄą░ą║čåąĖąĖ
ą¤čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ąŠą┤ąĮąŠą│ąŠ ąĖąĘ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĄ čüąĖčüč鹥ą╝čŗ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čĆąĄą░ą│ąĄąĮč鹊ą▓
ąóą░ą║ąŠąĄ ą▓ą╗ąĖčÅąĮąĖąĄ ą┐čĆąŠčÅą▓ą╗čÅąĄčéčüčÅ č鹊ą╗čīą║ąŠ ą┐čĆąĖ ą┤ąŠą▒ą░ą▓ą╗ąĄąĮąĖąĖ ą▓ čĆąĄą░ą║čåąĖąŠąĮąĮčāčÄ čüą╝ąĄčüčī ą╗ąĖčłčī ąŠą┤ąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ąĖą╗ąĖ ą┐čĆąŠą┤čāą║čéą░; ą║ąŠą╗ąĖč湥čüčéą▓ąŠ ą┤čĆčāą│ąĖčģ čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖą╗ąĖ ą┐čĆąŠą┤čāą║č鹊ą▓ ąŠčüčéą░čÄčéčüčÅ ąĮąĄąĖąĘą╝ąĄąĮąĮčŗą╝ąĖ ąĖ čĆą░čüčģąŠą┤čāčÄčéčüčÅ ą▓ ą┐čĆąŠčåąĄčüčüąĄ ą┐čĆąŠč鹥ą║ą░ąĮąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ, ą┐ąŠą║ą░ ąĮąĄ ą▒čāą┤ąĄčé ą┤ąŠčüčéąĖą│ąĮčāč鹊 ąĮąŠą▓ąŠąĄ čüąŠčüč鹊čÅąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čüąĖčüč鹥ą╝čŗ.
ą¤čĆąĖą╝ąĄčĆ.
ąÜąŠąĮčéą░ą║čéąĮčŗą╣ ą╝ąĄč鹊ą┤ ą┐ąŠą╗čāč湥ąĮąĖčÅ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ čéčĆąĄą▒čāąĄčé ą║ą░ą║ ą╝ąŠąČąĮąŠ ą▒ąŠą╗ąĄąĄ ą┐ąŠą╗ąĮąŠą│ąŠ ą┐čĆąĄąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą┤ąĖąŠą║čüąĖą┤ą░ čüąĄčĆčŗ ą▓ čéčĆąĖąŠą║čüąĖą┤ čüąĄčĆčŗ:
2SO2 + O2 Ōćä 2SO3
ąŻą▓ąĄą╗ąĖčćąĖčéčī ą▓čŗčģąŠą┤ SO3 ą▓ ą║ąŠąĮč鹥ą║čüč鹥 ąĖąĘą╝ąĄąĮąĄąĮąĖčÅ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖą╣ čĆąĄą░ą│ąĄąĮč鹊ą▓, ą╝ąŠąČąĮąŠ čüą╗ąĄą┤čāčÄčēąĖą╝ąĖ čüą┐ąŠčüąŠą▒ą░ą╝ąĖ:
- ą¤ąŠą▓čŗčüąĖčéčī ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÄ SO2 (ąĮąĄ čĆąĄąĮčéą░ą▒ąĄą╗čīąĮąŠ ąĖ 菹║ąŠą╗ąŠą│ąĖč湥čüą║ąĖ ąŠą┐ą░čüąĮąŠ);
- ą¤ąŠą▓čŗčüąĖčéčī ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÄ O2.
ąÆ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ąĄ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ ą▒ąŠą╗čīčłą░čÅ čüč鹥ą┐ąĄąĮčī ą║ąŠąĮą▓ąĄčĆčüąĖąĖ SO2 ą▓ SO3 ą┤ąŠčüčéąĖą│ą░ąĄčéčüčÅ ą┐čĆąĖ ąĖąĘą▒čŗčéą║ąĄ ą▓ čüąĖčüč鹥ą╝ąĄ ą▓ąŠąĘą┤čāčģą░ ąŠą▒ąŠą│ą░čēąĄąĮąĮąŠą│ąŠ ą║ąĖčüą╗ąŠčĆąŠą┤ąŠą╝.
ąÆ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ čģą╗ąŠčĆąĖą┤ą░ ą╝ąĄą┤ąĖ (II) ą┐čĆąŠč鹥ą║ą░ąĄčé čĆą░ą▓ąĮąŠą▓ąĄčüąĮą░čÅ čĆąĄą░ą║čåąĖčÅ
Cu2+ + 3Cl– Ōćä [CuCl3]–
ąĀą░ą▓ąĮąŠą▓ąĄčüąĮąŠąĄ čüąŠčüč鹊čÅąĮąĖąĄ ą┐čĆąĖ ąĮąĖąĘą║ąŠą╣ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ Cl– čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā čĆąĄą░ą│ąĄąĮč鹊ą▓ – čĆą░čüčéą▓ąŠčĆ ąĖą╝ąĄąĄčé ą│ąŠą╗čāą▒čāčÄ ąŠą║čĆą░čüą║čā. ąĢčüą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆ ą┤ąŠą▒ą░ą▓ąĖčéčī ąĖąĘą▒čŗč鹊ą║ čģą╗ąŠčĆąĖą┤-ąĖąŠąĮąŠą▓ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, ą┤ąŠą▒ą░ą▓ąĖą▓ čĆą░čüčéą▓ąŠčĆ čüąŠą╗čÅąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ) čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠąĄ čüąŠčüč鹊čÅąĮąĖąĄ čüą╝ąĄčēą░ąĄčéčüčÅ ą▓ čüč鹊čĆąŠąĮčā ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą┐čĆąŠą┤čāą║č鹊ą▓ ąĖ ąŠą║čĆą░čüą║ą░ čĆą░čüčéą▓ąŠčĆą░ ą╝ąĄąĮčÅąĄčéčüčÅ ąĮą░ ąĘąĄą╗ąĄąĮčŗą╣ čåą▓ąĄčé.










