ąÜąŠą╗ąĖč湥čüčéą▓ąĄąĮąĮąŠąĄ ąŠą┐ąĖčüą░ąĮąĖąĄ ąŠą▒čĆą░čéąĖą╝čŗčģ čĆąĄą░ą║čåąĖą╣ ą╝ąŠąČąĮąŠ ą┐čĆąŠą▓ąŠą┤ąĖčéčī ąĖčüą┐ąŠą╗čīąĘčāčÅ ąĘą░ą║ąŠąĮ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü (ąĘą░ą║ąŠąĮ ą┤ąĄą╣čüčéą▓ąĖčÅ ą╝ą░čüčü), ą║ąŠč鹊čĆčŗą╣ ą▒čŗą╗ ąŠčéą║čĆčŗčé ą▓ 1867 ą│ąŠą┤čā ąĮąŠčĆą▓ąĄąČčüą║ąĖą╝ čāč湥ąĮčŗą╝ ą╝ą░č鹥ą╝ą░čéąĖą║ąŠą╝ ąōčāą╗čīą┤ą▒ąĄčĆą│ąŠą╝ ąĖ čģąĖą╝ąĖą║ąŠą╝ ąÆą░ą░ą│ąĄ.
ąōčāą╗čīą┤ą▒ąĄčĆą│ ąĖ ąÆą░ą░ą│ąĄ ąĮą░čłą╗ąĖ, čćč鹊 čģąĖą╝ąĖč湥čüą║ąŠąĄ ą┤ąĄą╣čüčéą▓ąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░ ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮąŠ ąĄą│ąŠ ą░ą║čéąĖą▓ąĮąŠą╣ ą╝ą░čüčüąĄ. ą¤ąŠą┤ ą░ą║čéąĖą▓ąĮąŠą╣ ą╝ą░čüčüąŠą╣ ąŠąĮąĖ ą┐ąŠąĮąĖą╝ą░ą╗ąĖ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÄ – čćą░čüčéąĮąŠąĄ ąŠčé ą┤ąĄą╗ąĄąĮąĖčÅ ą╝ą░čüčüčŗ ąĮą░ ąŠą▒čŖąĄą╝. ąōčāą╗čīą┤ą▒ąĄčĆą│ ąĖ ąÆą░ą░ą│ąĄ ąĖą╝ąĄą╗ąĖ ą▓ ą▓ąĖą┤čā čéčā ąČąĄ ą▓ąĄą╗ąĖčćąĖąĮčā, ą║ąŠč鹊čĆčāčÄ čüąĄą│ąŠą┤ąĮčÅ ąĮą░ąĘčŗą▓ą░čÄčé ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ, ąĖ ą║ąŠč鹊čĆą░čÅ ą┐čĆąĖčĆą░ą▓ąĮąĖą▓ą░ąĄčéčüčÅ ą║ ą░ąĮą░ą╗ąĖčéąĖč湥čüą║ąŠą╣ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą▓ ąŠą▒ą╗ą░čüčéąĖ ą╝ą░ą╗ąŠą│ąŠ čüąŠą┤ąĄčƹȹ░ąĮąĖčÅ ą▓ąĄčēąĄčüčéą▓ą░.
ą¤čĆąĖą╝ąĄąĮąĖč鹥ą╗čīąĮąŠ ą║ ą┐čĆąŠčüčéčŗą╝ ą│ąŠą╝ąŠą│ąĄąĮąĮčŗą╝ čĆąĄą░ą║čåąĖčÅą╝ čéąĖą┐ą░ A + B Ōćä C + D, ą▓ ą║ąŠč鹊čĆčŗčģ ą▓čüąĄ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąŠąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ čĆą░ą▓ąĮčŗ ąĄą┤ąĖąĮąĖčåąĄ, ąŚą░ą║ąŠąĮ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü č乊čĆą╝čāą╗ąĖčĆčāąĄčéčüčÅ čüą╗ąĄą┤čāčÄčēąĖą╝ ąŠą▒čĆą░ąĘąŠą╝:
ąźąĖą╝ąĖč湥čüą║ą░čÅ čĆąĄą░ą║čåąĖčÅ ąĮą░čģąŠą┤ąĖčéčüčÅ ą▓ čüąŠčüč鹊čÅąĮąĖąĖ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ, ąĄčüą╗ąĖ ąŠčéąĮąŠčłąĄąĮąĖąĄ ą┐čĆąŠąĖąĘą▓ąĄą┤ąĄąĮąĖčÅ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖą╣ ą┐čĆąŠą┤čāą║č鹊ą▓ ą║ ą┐čĆąŠąĖąĘą▓ąĄą┤ąĄąĮąĖčÄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖą╣ čĆąĄą░ą│ąĄąĮč鹊ą▓ ą┤ąŠčüčéąĖą│ą░ąĄčé ą┐ąŠčüč鹊čÅąĮąĮąŠą│ąŠ ąĘąĮą░č湥ąĮąĖčÅ, čģą░čĆą░ą║č鹥čĆąĮąŠą│ąŠ ą┤ą╗čÅ čŹč鹊ą╣ čĆąĄą░ą║čåąĖąĖ ą┐čĆąĖ ą┤ą░ąĮąĮąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĄ
ą£ą░č鹥ą╝ą░čéąĖč湥čüą║ąŠąĄ ą▓čŗčĆą░ąČąĄąĮąĖąĄ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü č湥čĆąĄąĘ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą▓ąĄčēąĄčüčéą▓ c ąĖą╗ąĖ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ a ą┤ą╗čÅ ą┐čĆąŠčüčéčŗčģ čĆąĄą░ą║čåąĖą╣:
A + B Ōćä C + D
(cC * cD) / (cA * cB) = Kc
(aC * aD) / (aA * aB) = Ka
ąŚą░ą║ąŠąĮ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü čāąĮąĖą▓ąĄčĆčüą░ą╗ąĄąĮ ąĖ ąĄą│ąŠ ą╝ąŠąČąĮąŠ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī ą┤ą╗čÅ čĆą░čüč湥č鹊ą▓ ąĮąĄąĘą░ą▓ąĖčüąĖą╝ąŠ ąŠčé čüą╗ąŠąČąĮąŠčüčéąĖ čĆąĄą░ą║čåąĖąĖ.
ąöą╗čÅ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĖčÅ ą┐čĆą░ą║čéąĖč湥čüą║ąĖčģ čĆą░čüč湥č鹊ą▓ ą▓čŗčĆą░ąČąĄąĮąĖąĄ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü ąĘą░ą┐ąĖčüčŗą▓ą░čÄčé č湥čĆąĄąĘ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ, čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖąĄ čüąŠčüč鹊čÅąĮąĖčÄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ; čéą░ą║ąĖąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ąŠą▒ąŠąĘąĮą░čćą░čÄčé č乊čĆą╝čāą╗ą░ą╝ąĖ ą▓ąĄčēąĄčüčéą▓, ąĘą░ą║ą╗čÄč湥ąĮąĮčŗą╝ąĖ ą▓ ą║ą▓ą░ą┤čĆą░čéąĮčŗąĄ čüą║ąŠą▒ą║ąĖ:
Kc = ([C][D]) / ([A][B]) = const = f(T)
ąÆąĄą╗ąĖčćąĖąĮą░ Kc ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ąÜąŠąĮčüčéą░ąĮčéą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ. ą×ąĮą░ ąĘą░ą▓ąĖčüąĖčé č鹊ą╗čīą║ąŠ ąŠčé č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ.
ą¤čĆąĖą╝ąĄčĆ. ąöą╗čÅ ąŠą▒čĆą░čéąĖą╝ąŠą╣ ą│ąŠą╝ąŠą│ąĄąĮąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ ą║ąŠąĮą▓ąĄčĆčüąĖąĖ ąŠą║čüąĖą┤ą░ čāą│ą╗ąĄčĆąŠą┤ą░ ą▓ąŠą┤čÅąĮčŗą╝ ą┐ą░čĆąŠą╝ (ą║ąŠąĮą▓ąĄčĆčüąĖčÅ ą▓ąŠą┤čÅąĮąŠą│ąŠ ą│ą░ąĘą░) ą║ąŠąĮčüčéą░ąĮčéą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čĆą░ą▓ąĮą░
CO + H2O Ōćä CO2 + H2 (T = 800 K)
Kc = ([CO2][H2]) / ([CO][H2O]) = 4
ą×ą▒čŗčćąĮąŠ ą▓ ąĘą░ą║ąŠąĮąĄ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü čüąŠą┤ąĄčƹȹ░ąĮąĖąĄ ą║ą░ąČą┤ąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ąĘą░ą┤ą░čÄčé ąĄą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠą╣ ą╝ąŠą╗čÅčĆąĮąŠą╣ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĄą╣, ą▓čŗčĆą░ąČąĄąĮąĮąŠą╣ ą▓ ą╝ąŠą╗čī/ą┤ą╝3, ąĮąŠ ąŠąĮ ą╝ąŠąČąĄčé ą▒čŗčéčī ąĘą░ą┐ąĖčüą░ąĮ ąĖ čü čāą║ą░ąĘą░ąĮąĖąĄą╝ čĆą░ą▓ąĮąŠą▓ąĄčüąĮčŗčģ ą╝ąŠą╗čīąĮčŗčģ ą┤ąŠą╗ąĄą╣ ąĖą╗ąĖ čĆą░ą▓ąĮąŠą▓ąĄčüąĮčŗčģ ą┐ą░čĆčåąĖą░ą╗čīąĮčŗčģ ą┤ą░ą▓ą╗ąĄąĮąĖą╣ ą▓ąĄčēąĄčüčéą▓.
ąŚą░ą┐ąĖčüčī ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü č湥čĆąĄąĘ ą╝ąŠą╗čÅčĆąĮčŗąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čāą┤ąŠą▒ąĮą░ ą┤ą╗čÅ čĆąĄą░ą║čåąĖą╣, ą┐čĆąŠč鹥ą║ą░čÄčēąĖčģ ą▓ čĆą░čüčéą▓ąŠčĆą░čģ. ą£ąŠą╗čīąĮčŗąĄ ą┤ąŠą╗ąĖ čāą┤ąŠą▒ąĮąĄąĄ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī ą┤ą╗čÅ ąŠą┐ąĖčüą░ąĮąĖčÅ čĆąĄą░ą║čåąĖą╣ ą╝ąĄąČą┤čā ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╝ąĖ ą▓ąĄčēąĄčüčéą▓ą░ą╝ąĖ.
ą£ąŠą╗čīąĮą░čÅ ą┤ąŠą╗čÅ ą▓ąĄčēąĄčüčéą▓ą░ – čŹč鹊 ąŠčéąĮąŠčłąĄąĮąĖąĄ č乊čĆą╝čāą╗čīąĮąŠą│ąŠ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą▓ąĄčēąĄčüčéą▓ą░ ą║ čüčāą╝ą╝ąĄ č乊čĆą╝čāą╗čīąĮčŗčģ ą║ąŠą╗ąĖč湥čüčéą▓ ą▓čüąĄčģ ą▓ąĄčēąĄčüčéą▓ čüą╝ąĄčüąĖ:
x(B) = n(B) / (n(A) + n(B) + n(C) + n(D)) = n(B) / Ōłæn(A-D)
ą¤čĆąĖą╝ąĄąĮąĖč鹥ą╗čīąĮąŠ ą║ ąŠą▒čĆą░čéąĖą╝čŗą╝ ą│ą░ąĘąŠą▓čŗą╝ čĆąĄą░ą║čåąĖčÅą╝ ąĘą░ą║ąŠąĮ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü ą▓čŗčĆą░ąČąĄąĮąĮčŗą╣ č湥čĆąĄąĘ ą╝ąŠą╗čīąĮčŗąĄ ą┤ąŠą╗ąĖ ąĖą╝ąĄąĄčé čüą╗ąĄą┤čāčÄčēąĖą╣ ą▓ąĖą┤:
A + B Ōćä C + D
Kx = (xC * xD) / (xA * xB) = const = f(T)
ą¤čĆąĖą╝ąĄčĆ. ąÆ čĆąĄą░ą║čåąĖąĖ ą║ąŠąĮą▓ąĄčĆčüąĖąĖ ą▓ąŠą┤čÅąĮąŠą│ąŠ ą│ą░ąĘą░ čüąŠčüč鹊čÅąĮąĖąĄ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ ą┐čĆąĖ 800 K čāčüčéą░ąĮąŠą▓ąĖą╗ąŠčüčī čéą░ą║, čćč鹊 ąĖąĘ ąĮą░čćą░ą╗čīąĮčŗčģ ą║ąŠą╗ąĖč湥čüčéą▓ ą▓ąĄčēąĄčüčéą▓ CO ąĖ H2O, čĆą░ą▓ąĮčŗčģ ą┐ąŠ 3 ą╝ąŠą╗čī ą┤ą╗čÅ ą║ą░ąČą┤ąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░, ąŠą▒čĆą░ąĘąŠą▓ą░ą╗ąŠčüčī ą┐ąŠ 2 ą╝ąŠą╗čī ą┐čĆąŠą┤čāą║č鹊ą▓ (CO2 ąĖ H2):
ąĖčüčģąŠą┤ąĮą░čÅ čüą╝ąĄčüčī – 3CO + 3H2O ŌåÆ CO + H2O + 2CO2 + 2H2 – čĆą░ą▓ąĮąŠą▓ąĄčüąĮą░čÅ čüą╝ąĄčüčī
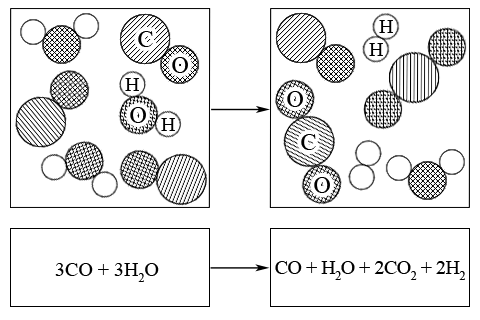
ąĀą░ą▓ąĮąŠą▓ąĄčüąĮčŗąĄ ą╝ąŠą╗čīąĮčŗąĄ ą┤ąŠą╗ąĖ ą▓ąĄčēąĄčüčéą▓ ą▓ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą╝ąĄčüąĖ čĆą░ą▓ąĮčŗ (čüčāą╝ą╝ą░čĆąĮąŠąĄ ą║ąŠą╗ąĖč湥čüčéą▓ąŠ ą▓čüąĄčģ ą▓ąĄčēąĄčüčéą▓ čüąŠčüčéą░ą▓ą╗čÅąĄčé 6 ą╝ąŠą╗čī):
x(CO2) = 2 / 6; x(H2) = 2 / 6; x(CO) = 1 / 6; x(H2O) = 1 / 6
ąŠčéą║čāą┤ą░
Kx = (x(CO2) * x(H2)) / (x(CO) * x(H2O)) = ((2/6) * (2/6)) / ((1/6) * (1/6)) = 4 (T = 800 K)
ąöą╗čÅ čüą╗ąŠąČąĮčŗčģ ą│ąŠą╝ąŠą│ąĄąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣, ą▓ čāčĆą░ą▓ąĮąĄąĮąĖčÅčģ ą║ąŠč鹊čĆčŗčģ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ ą┐čĆąĖ č乊čĆą╝čāą╗ą░čģ (čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ) ąĮąĄ čĆą░ą▓ąĮčŗ ąĄą┤ąĖąĮąĖčåąĄ, ą▓ ą▓čŗčĆą░ąČąĄąĮąĖąĖ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü čüą╗ąĄą┤čāąĄčé čāčćąĖčéčŗą▓ą░čéčī čŹčéąĖ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ.
ąÜąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ čāčĆą░ą▓ąĮąĄąĮąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ ą▓ ą▓čŗčĆą░ąČąĄąĮąĖąĖ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü ą▓čŗčüčéčāą┐ą░čÄčé ą▓ ą║ą░č湥čüčéą▓ąĄ ą┐ąŠą║ą░ąĘą░č鹥ą╗ąĄą╣ čüč鹥ą┐ąĄąĮąĄą╣ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖčģ čĆą░ą▓ąĮąŠą▓ąĄčüąĮčŗčģ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖą╣
aA + bB Ōćä cC + dD
Kc = ([C]c[D]d) / ([A]a[B]b) = const = f(T)
ą¤čĆąĖą╝ąĄčĆ. ąöą╗čÅ ąŠą▒čĆą░čéąĖą╝ąŠą╣ čĆąĄą░ą║čåąĖąĖ čüąĖąĮč鹥ąĘą░ ą░ą╝ą╝ąĖą░ą║ą░ ą▓čŗčĆą░ąČąĄąĮąĖąĄ ą║ąŠąĮčüčéą░ąĮčéčŗ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ ą▒čāą┤ąĄčé ąĖą╝ąĄčéčī čüą╗ąĄą┤čāčÄčēąĖą╣ ą▓ąĖą┤:
N2 + 3H2 Ōćä 2NH3
Kc = ([NH3]2) / ([N2][H2]3)
ąöą╗čÅ ą║ą░ąČą┤ąŠą╣ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ ą┐čĆąĖ T = const ą▓ąĄą╗ąĖčćąĖąĮą░ Kc ąĖą╝ąĄąĄčé ą▓ą┐ąŠą╗ąĮąĄ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮąŠąĄ, ą┐čĆąĖčüčāčēąĄąĄ č鹊ą╗čīą║ąŠ čŹč鹊ą╣ čĆąĄą░ą║čåąĖąĖ ąĘąĮą░č湥ąĮąĖąĄ ąĖ ą┐čĆąĖ ąĖąĘą╝ąĄąĮąĄąĮąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĘąĮą░č湥ąĮąĖąĄ Kc ą┤ą░ąĮąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ ą╝ąĄąĮčÅąĄčéčüčÅ. ąÜąŠąĮčüčéą░ąĮčéą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ čĆąĄą░ą║čåąĖą╣ ą╝ąŠąČąĄčé ą▒čŗčéčī čĆą░čüčüčćąĖčéą░ąĮą░ ą┐ąŠ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗą╝ ą┤ą░ąĮąĮčŗą╝; ą┤ą╗čÅ ą╝ąĮąŠą│ąĖčģ čĆąĄą░ą║čåąĖą╣ ąĘąĮą░č湥ąĮąĖčÅ Kc ą┐čĆąĖą▓ąĄą┤ąĄąĮčŗ ą▓ čüą┐čĆą░ą▓ąŠčćąĮąĖą║ą░čģ.
ąÆ ą▓čŗčĆą░ąČąĄąĮąĖąĖ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą┐čĆąŠą┤čāą║č鹊ą▓ čüč鹊čÅčé ą▓ čćąĖčüą╗ąĖč鹥ą╗ąĄ, ą░ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čĆąĄą░ą│ąĄąĮč鹊ą▓ – ą▓ ąĘąĮą░ą╝ąĄąĮą░č鹥ą╗ąĄ, ą┐ąŠčŹč鹊ą╝čā ą┤ąĄą╣čüčéą▓ąĖč鹥ą╗čīąĮčŗ čüą╗ąĄą┤čāčÄčēąĖąĄ čāčéą▓ąĄčƹȹ┤ąĄąĮąĖčÅ:
ą¦ąĄą╝ ą▓čŗčłąĄ ą║ąŠąĮčüčéą░ąĮčéą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ, č鹥ą╝ ą▓ ą▒ąŠą╗čīčłąĄą╣ čüč鹥ą┐ąĄąĮąĖ ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠą╣ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą╝ąĄčüąĖ ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░čÄčé ą┐čĆąŠą┤čāą║čéčŗ;
ą¦ąĄą╝ ąĮąĖąČąĄ ą║ąŠąĮčüčéą░ąĮčéą░ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ, č鹥ą╝ ą▓ ą▒ąŠą╗čīčłąĄą╣ čüč鹥ą┐ąĄąĮąĖ ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĮąŠą╣ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą╝ąĄčüąĖ ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░čÄčé čĆąĄą░ą│ąĄąĮčéčŗ
ąöą╗čÅ ą│ąŠą╝ąŠą│ąĄąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣ čéąĖą┐ą░
A + B Ōćä C + D
ąĖ ą▓čüąĄčģ ą┤čĆčāą│ąĖčģ čĆąĄą░ą║čåąĖą╣, ą▓ ą║ąŠč鹊čĆčŗčģ čüčāą╝ą╝ą░čĆąĮąŠąĄ ą║ąŠą╗ąĖč湥čüčéą▓ąŠ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆą░ą▓ąĮąŠ čüčāą╝ą╝ą░čĆąĮąŠą╝čā ą║ąŠą╗ąĖč湥čüčéą▓čā čĆąĄą░ą│ąĄąĮč鹊ą▓, čüą┐čĆą░ą▓ąĄą┤ą╗ąĖą▓čŗ čüą╗ąĄą┤čāčÄčēąĖąĄ ąĘą░ą║ąŠąĮąŠą╝ąĄčĆąĮąŠčüčéąĖ:
- Kc > 1 – ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░čÄčé ą┐čĆąŠą┤čāą║čéčŗ, ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ ą┐čĆąŠą┤čāą║č鹊ą▓ ą▒ąŠą╗čīčłąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čĆąĄą░ą│ąĄąĮč鹊ą▓;
- Kc = 1 – ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆą░ą▓ąĮčŗ;
- Kc < 1 – ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░čÄčé čĆąĄą░ą│ąĄąĮčéčŗ, ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ čĆąĄą░ą│ąĄąĮč鹊ą▓ ą▓čŗčłąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą┐čĆąŠą┤čāą║č鹊ą▓.
ąŁčéąĖ ąČąĄ ą▓čŗą▓ąŠą┤čŗ ą┐ąŠą╗čāčćą░čÄčéčüčÅ ą┐čĆąĖ ą┐ąŠą┤čüčéą░ąĮąŠą▓ą║ąĄ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖčģ ąĘąĮą░č湥ąĮąĖą╣ Kc ą▓ ą▓čŗčĆą░ąČąĄąĮąĖąĄ ą┤ą╗čÅ čĆą░čüč湥čéą░ čüčéą░ąĮą┤ą░čĆčéąĮąŠą╣ 菹ĮąĄčĆą│ąĖąĖ ąōąĖą▒ą▒čüą░ čĆąĄą░ą║čåąĖąĖ.
ąĢčüą╗ąĖ ą▓ ąŠą▒čĆą░čéąĖą╝ąŠą╣ čĆąĄą░ą║čåąĖąĖ, ą┐ąŠą╝ąĖą╝ąŠ ą│ą░ąĘąŠą▓, ą┐čĆąĖąĮąĖą╝ą░čÄčé čāčćą░čüčéąĖąĄ čéą▓ąĄčĆą┤čŗąĄ ąĖ ą╝ą░ą╗ąŠą╗ąĄčéčāčćąĖąĄ ąČąĖą┤ą║ąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░, č鹊 ą▓čŗčĆą░ąČąĄąĮąĖąĄ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü ą┐čĆąĖąĮąĖą╝ą░ąĄčé ą▓ąĖą┤:
A (ą│ą░ąĘ) + B (čé) Ōćä C (ąČ) + D (ą│ą░ąĘ)
Kc = [D] / [A] = const = f(T)
ąÜąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čéą▓ąĄčĆą┤čŗčģ ąĖ ąČąĖą┤ą║ąĖčģ ą▓ąĄčēąĄčüčéą▓, čĆą░ą▓ąĮčŗąĄ ąŠčéąĮąŠčłąĄąĮąĖčÄ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ąĄčēąĄčüčéą▓ą░ Žü ą║ ąĄą│ąŠ ą╝ąŠą╗čÅčĆąĮąŠą╣ ą╝ą░čüčüąĄ M
c = n / V = (m / M) / (m / Žü) = Žü / M = const = f(T)
ą▓čģąŠą┤čÅčé ą║ą░ą║ ą║ąŠąĮčüčéą░ąĮčéčŗ ą┐čĆąĖ T = const ą▓ ą▓ąĄą╗ąĖčćąĖąĮčā Kc ąĖ ą┐ąŠčŹč鹊ą╝čā ąŠčéčüčāčéčüčéą▓čāčÄčé ą▓ ą┐čĆą░ą▓ąŠą╣ čćą░čüčéąĖ ą▓čŗčĆą░ąČąĄąĮąĖčÅ ą┤ą╗čÅ ąĘą░ą║ąŠąĮą░ ą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą╝ą░čüčü.
ą¤čĆąĖą╝ąĄčĆ. ąÆčŗčĆą░ąČąĄąĮąĖčÅą╝ąĖ ą┤ą╗čÅ Kc čüą╗ąĄą┤čāčÄčēąĖčģ čĆąĄą░ą║čåąĖą╣ ą▒čāą┤čāčé:
C (čé) + CO2 (ą│ą░ąĘ) Ōćä 2CO (ą│ą░ąĘ); Kc = [CO]2 / [CO2]
MgCO3 (čé) Ōćä MgO (čé) + CO2 (ą│ą░ąĘ); Kc = [CO2]
H2O (ą│ą░ąĘ) + SO3 (ą│ą░ąĘ) Ōćä H2SO4 (ąČ); Kc = 1 / ([H2O][SO3])
ąóą░ą║ąĖą╝ ąČąĄ ąŠą▒čĆą░ąĘąŠą╝ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąĮąĄ čāčćąĖčéčŗą▓ą░čÄčéčüčÅ čéą▓ąĄčĆą┤čŗąĄ čäą░ąĘčŗ (ąŠčüą░ą┤ą║ąĖ):
Ca2+ + 2F– Ōćä CaF2 (čé); Kc = 1 / ([Ca2+][F–]2)
Cu2+ + Zn (čé) Ōćä Cu (čé) + Zn2+; Kc = [Zn2+] / [Cu2+]










