Фосфор P открыт в 1669 году (Бранд, Германия) в результате алхимических поисков философского камня (в частности, обнаружен в остатках мочи после ее выпаривания).
Распространение фосфора в природе. Встречается только в химически связанном виде в организмах и минералах. В живых организмах фосфор содержится в форме фосфолипидов (например, лецитин в нервном и мозговом веществе), фосфопротеидов (ферменты), различных эфиров ортофосфорной кислоты и ортофосфата кальция (в костях и зубах). Экскременты птиц образуют природное фосфорсодержащее вещество – гуано.
Минералы фосфора: фосфорит 2Ca3(PO4)2*Ca(OH)2; апатит 3Ca3(PO4)2*Ca(Cl,OH, F)2; монацит CePO4.
Фосфаты содержатся также в некоторых рудах железа.
Физиологическое действие фосфора. Фосфор – жизненно важный элемент для всех организмов.
Таблица. Свойства аллотропных модификаций фосфора.
|
Белый фосфор |
Красный фосфор |
Черный фосфор |
|
|
Цвет |
Белый |
От красного до фиолетового |
Серо-черный |
|
Запах |
Чесночный |
Не имеет |
Не имеет |
|
По степени твердости |
Воскообразный |
Твердый |
Относительно мягкий |
|
Характер модификации |
Неметаллические |
Металлический |
|
|
Температура плавления, *С |
44 |
Плавятся только под избыточным давлением; выше 280*С переходят в пар белого фосфора |
|
|
Температура возгонки, *С |
60 |
Выше 400 |
Выше 400 |
|
Плотность при 20*С, г./см3 |
1,82 |
2,36 |
2,70 |
|
Растворимость |
Мало растворим в H2O, хорошо – в CS2 |
Нерастворимые |
|
|
Реакционная способность |
Высокая |
Низкая |
Средняя |
|
Люминесценция |
Есть |
Нет |
Нет |
Свойства фосфора. Известно несколько аллотропных модификаций фосфора, среди которых наиболее распространенные белый, красный и черный фосфор.
Между модификациями фосфора осуществляются следующие переходы:
- белый фосфор → красный фосфор; процесс протекает медленно при комнатной температуре, ускоряется при нагревании в закрытом сосуде при 330*С;
- красный фосфор → белый фосфор; выше 280*С красный фосфор перегоняется при нормальном атмосферном давлении и конденсируется в виде белого фосфора;
- белый фосфор → черный фосфор; переход протекает при ударном прессовании под давлением 10000 МПа или при нормальном атмосферном давлении и 380*С на катализаторе (мелкодисперсная ртуть).
Белый фосфор получают из фосфата кальция Ca3(PO4)2 (фосфорита) при нагревании с песком (SiO2) и коксом (C):
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Газообразную смесь (фосфор и монооксид углерода) пропускают через воду, при этом белый фосфор конденсируется. Белый фосфор состоит из молекул P4. В темноте на воздухе он обнаруживает зеленоватое свечение (люминесценция), сопровождающееся выделением теплоты; это явление обусловлено медленным окислением фосфора кислородом воздуха
P4 + 3O2 = P4O6
причем выделяющаяся теплота может расплавить фосфор и привести к его воспламенению (поэтому белый фосфор хранят под водой). При горении фосфора образуется белый дым – мелкие частички декаоксида тетрафосфора P4O10. Горящий фосфор нельзя гасить водой, его следует засыпать песком!
В растворе щелочи фосфор диспропорционирует, образуя соединения фосфора (+1) и фосфора (-III):
P4 + 3KOH + 3H2O = 3K(PH2O2) + PH3
Белый фосфор применяют для получения других его аллотропных модификаций, фосфорных кислот и фосфатов, как боевое зажигательное вещество (использование белого фосфора в качестве боевого зажигательного вещества запрещено международным договором).
Белый фосфор чрезвычайно ядовит, смертельная доза составляет 50 – 500 мг, он может попадать в организм через органы дыхания и пищеварения, всасывается через кожу (в местах ее повреждения). Хроническое отравление фосфором проявляется в поражении костей и исхудании.
Красный фосфор более устойчив и менее реакционноспособен, чем белый фосфор. Красный фосфор не ядовит, однако поступающие в продажу образцы часто содержат ощутимые количества белого фосфора, что следует учитывать при работе с товарными образцами фосфора. Применяют при изготовлении спичек и как наполнитель (пары) в лампах накаливания. Рабочая поверхность (намазка) спичечного коробка содержит смесь красного фосфора, сульфида сурьмы(III) Sb2S3 и стекольного порошка, которая закреплена на связующем – декстриновом клее; в состав спичечной головки входят хлорат калия KClO3, сера и др. При быстром проведении головкой спички по рабочей поверхности коробка хлорат калия окисляет фосфор, что сопровождается воспламенением серы, а затем и древесной основы спички. В состав головки универсальных (петровых, охотничьих) спичек входит P4S3, такие спички не гаснут на ветру.
Черный фосфор имеет, как и графит, слоистую решетку; проводит электрический ток. Не ядовит.
Фосфорные кислоты. Фосфаты
Оксид фосфора(V) P2O5 (точнее, P4O10) – кислотный оксид, которому соответствуют фосфорные кислоты. Белое гигроскопичное порошкообразное (при полном отсутствии влаги) вещество. Возгоняется при 359*С. Взаимодействует с водой с образованием фосфорных кислот. Применяют в качестве эффективного водопоглощающего средства (в эксикаторах и т. п.).
В зависимости от количества воды, реагирующей с оксидом фосфора, образуются следующие фосфорные кислоты:
Метафосфорная кислота
P4O10 + 2H2O = 4HPO3 точнее (HPO3)n
Дифосфорная кислота (ранее применяемое название – пирофосфорная кислота)
P4O10 + 4H2O = 2H4P2O7
Ортофосфорная кислота (или просто фосфорная кислота)
P4O10 + 6H2O = 4H3PO4
Известны соли всех этих кислот: мета-, ди- и ортофосфаты (часто просто фосфаты).
Ортофосфорная кислота H3PO4 – бесцветные кристаллы; с небольшим количеством воды образует сиропообразный, неядовитый раствор с сильным кислым вкусом.
Способ обнаружения ортофосфорной кислоты заключается в добавлении раствора кислоты (или ортофосфата какого-либо металла) в сильно подкисленный азотной кислотой раствор молибдата аммония при нагревании – выпадает желтый порошкообразный осадок молибдофосфата аммония.
Ортофосфорную кислоту применяют для получения ортофосфатов, для фосфатирования железа и цинка, в приготовлении электролитических и химических полировальных смесей для металлов (вместе с серной и хромовой кислотами), в технологии безалкогольных напитков, для производства катализаторов и лекарственных средств.
Ортофосфаты образуются при ступенчатой нейтрализации ортофосфорной кислоты. Поскольку эта кислота трехосновная, она образует три ряда солей: средние и два типа кислых солей, например:
NaH2PO4 – дигидроортофосфат натрия
Na2HPO4 – гидроортофосфат натрия
Na3PO4 – ортофосфат натрия
Ca(H2PO4)2 – дигидроортофосфат кальция (растворим в воде)
CaHPO4 – гидроортофосфат кальция (не растворим в воде, растворяется в растворе лимонной кислоты)
Ca3(PO4)2 – ортофосфат кальция (нерастворим в воде и в растворе лимонной кислоты)
Хорошо растворимы в воде следующие ортофосфаты: средние ортофосфаты щелочных элементов (кроме лития, а также аммония); моногидроортофосфаты щелочных элементов; дигидроортофосфаты щелочных и некоторых (особенно двухвалентных) тяжелых металлов. Все остальные ортофосфаты в воде практически нерастворимы.
Применение ортофосфатов весьма разнообразно. Их используют как минеральные удобрения, в качестве умягчителей воды (Na3PO4) и огнестойкой пропитки (соль (NH4)2HPO4), для изготовления фармацевтических и косметических препаратов, как составную часть питательной среды для дрожжей и в сыроварении (предохраняют от отделения сыворотки и жира), для процесса фосфатирования.
Дифосфаты получаются при нагревании моногидроортофосфатов, например:
2Na2HPO4 = Na4P2O7 + H2O
Конденсированные фосфаты в качестве анионов содержат цепи и циклы типа
-P(O2)-O-P(O2)-O-
Метафосфаты, точная формула которых MeIn(PO3)n (n = 3, 4 и более), состоят из низкомолекулярных циклов, например триметафосфат натрия Na3P3O9. Полифосфаты с той же формулой MeIn(PO3)n содержат средне- и высокомолекулярные цепи; так называемые ультрафосфаты имеют пространственное сетчатое строение. Высокомолекулярный полифосфат натрия образуется в форме растворимой в воде соли Грэма (наряду с незначительными количествами мета- и ультрафосфатов) при отщеплении воды от дигидроортофосфата натрия при его плавлении. Соль Грэма (ранее называвшаяся гексаметафосфатом натрия) имеет строение:
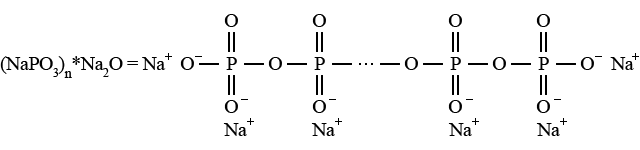
Соль Грэма используется как средство устраняющее жесткость воды: эта соль ведет себя как ионообменник и связывает ионы Са2+ и Mg2+, удаляя их из раствора (аналогичным свойством обладают среднемолекулярные полифосфаты, например триполифосфат пентанатрия Na5P3O10. Кроме того, эта соль проявляет хорошее моющее действие.
Фосфатирование – создание на поверхности металла (железа, цинка, алюминия) слоя фосфата, который предохраняет металл от коррозии и от слипания листов металла друг с другом (фосфатный лак). Фосфатирование поверхности металла достигается помещением изделия в горячий раствор дигидроортофосфатов цинка(II) Zn(H2PO4)2 и марганца(II) Mn(H2PO4)2, содержащий свободную фосфорную кислоту и иногда катализирующие добавки.
Соединения фосфора
Кроме указанных выше фосфорных кислот известны и другие фосфорсодержащие кислоты.
Фосфористая кислота H3PO3, или H2(HPO3) и фосфорноватистая кислота (или гипофосфористая кислота) H3PO2, или H(PH2O2). Эти соединения проявляют в водном растворе кислотные свойства; первая кислота – двухосновная, а вторая – одноосновная. Указанные кислоты образуют следующие соли: фосфиты MeI2HPO3 и гипофосфиты MeIH2PO2.
Гипофосфит натрия Na(PH2O2) кристаллизуется с одной молекулой воды; образуется при кипячении суспензии белого фосфора в растворе гидроксида натрия. Эту соль применяют при химическом (бестоковом) кобальтировании и никелировании.
Фосфин PH3 – бесцветный газ с рыбно-чесночным запахом, с температурой кипения -87,7*С. Очень ядовит! Образуется (в чистом виде) при гидролизе фосфидов, например:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Дифосфан P2H4 – бесцветная жидкость, с температурой кипения 51,7*С. Самовоспламеняется на воздухе и вызывает самовоспламенение фосфина PH3 (при получении PH3 путем кипячения суспензии белого фосфора в растворе щелочи P2H4 образуется как примесь).
Трихлорид фосфора PCl3 – бесцветная, пахнущая во влажном воздухе жидкость, с температурой кипения 74,5*С. При гидролизе образует фосфористую кислоту:
PCl3 + 3H2O = H2(PHO3) + 3HCl
Пентахлорид фосфора PCl5 – белое твердое вещество. При недостатке воды пентахлорид фосфора образует оксид-трихлорид фосфора PCl3O (часто с примесью метафосфорной кислоты):
PCl5 + H2O = PCl3O + 2HCl
а при избытке воды – ортофосфорную кислоту:
PCl5 + 4H2O = H3PO4 + 5HCl
Фосфорные удобрения. Содержат фосфор в качестве основного питательного элемента. Фосфорные и апатитовые руды вскрывают сухим или мокрым способом, при этом фосфор переводится в такие формы, которые легко усваиваются растениями из почвы.
Простой суперфосфат (16-20% P2O5; содержание фосфора в удобрениях по традиции пересчитывается на содержание оксида P2O5) получается при вскрытии руды (фосфорита Ca3(PO4)2) с помощью 60% серной кислоты. Содержит 35% Ca(H2PO4)2, 50% CaSO4, 8% H3PO4, и 7% других веществ. Упрощенное уравнение реакции, протекающей при обработке фосфорита серной кислотой:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
(Если исходным сырьем служит фторапатит 3Ca3(PO4)2*CaF2, то образуется фтороводород HF, который с песком (SiO2) выделяет летучий тетрафторид кремния SiF4).
Двойной суперфосфат (46-49 % P2O5) получается при вскрытии руды с помощью 40% ортофосфорной кислоты. Содержит Ca(H2PO4)2, немного CaHPO4 и в отличие от простого суперфосфата совсем не имеет балластного CaSO4. Упрощенное уравнение реакции, протекающей при обработке фосфорита фосфорной кислотой:
Ca3(PO4)2 + 4H3PO4 = 3Ca(HPO4)2
Магниевый плавленый фосфат (20% P2O5) получается сплавлением руды с кизеритом MgSO4*H2O и песком SiO2. Содержит ортофосфаты кальция, а также Mg3(PO4)2 и CaSO4.
Щелочной плавленый фосфат (25 % P2O5) получается при прокаливании (1100 – 1200*С) руды с содой Na2CO3 и песком SiO2. Содержит в качестве ценного компонента ортофосфат кальция-натрия NaCaPO4. Упрощенное уравнение реакции, протекающей при обработке руды:
2Ca3(PO4)2 + 2Na2CO3 + SiO2 = 4NaCaPO4 + Ca2SiO4 + 2CO2
Мартеновский фосфатшлак – мелкоразмолотые отходы (шлак) мартеновского способа передела богатых фосфором чугунов в сталь.
Смешанные удобрения, азотно-фосфорно-калийные удобрения, содержат основные питательные элементы в массовом соотношении N : P : K = 1 : 0,85 : 1,7. Для получения смешанных удобрений фосфоритно-апатитную руду обрабатывают последовательно азотной кислотой и сульфатом аммония (осадок CaSO4 отфильтровывают), затем раствор нейтрализуют водным аммиаком и к смеси добавляют KCl или K2SO4; твердое удобрение получают совместной кристаллизацией и гранулированием.










