ą×ą║čüąĖą│ąĄąĮąŠą▓č¢ čüą┐ąŠą╗čāą║ąĖ čüčāą╗čīčäčāčĆčā
ąĪčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ SO2
ą¤ąŠčłąĖčĆąĄąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā ą▓ ą┐čĆąĖčĆąŠą┤č¢. ąĪčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ ą╝č¢čüčéąĖčéčīčüčÅ ą▓ ą▓čāą╗ą║ą░ąĮč¢čćąĮąĖčģ ą│ą░ąĘą░čģ č¢ ą│ą░ąĘą░čģ, čēąŠ ą▓ąĖą┤č¢ą╗čÅčÄčéčīčüčÅ ą┐čĆąĖ čüą┐ą░ą╗čÄą▓ą░ąĮąĮč¢ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą▓čāą│č¢ą╗ą╗čÅ.
ą×čéčĆąĖą╝ą░ąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā.
- ąĪą┐ą░ą╗čÄą▓ą░ąĮąĮčÅ čüč¢čĆą║ąĖ ą░ą▒ąŠ ą│č¢ą┤čĆąŠą│ąĄąĮ čüčāą╗čīčäč¢ą┤čā.
S + O2 = SO2
- ą×ą▒čĆąŠą▒ą║ą░ čüčāą╗čīčäč¢čéč¢ą▓ čüąĖą╗čīąĮąĖą╝ąĖ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2
- ąÆąĖą┐ą░ą╗čÄą▓ą░ąĮąĮčÅ čüčāą╗čīčäč¢ą┤ąĮąĖčģ čĆčāą┤, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą┐č¢čĆąĖčéčā:
4Fe(S2) + 11O2 = 2Fe2O3 + 8SO2
- ąÆč¢ą┤ąĮąŠą▓ąĮąĖą╣ č鹥čĆą╝č¢čćąĮąĖą╣ čĆąŠąĘą║ą╗ą░ą┤ ą╝č¢ąĮąĄčĆą░ą╗č¢ą▓ ą│č¢ą┐čüčā CaSO4*2H2O ą░ą▒ąŠ ą░ąĮą│č¢ą┤čĆąĖčéčā CaSO4.
ą×čüčéą░ąĮąĮč¢ ą┤ą▓ą░ ą╝ąĄč鹊ą┤ąĖ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčīčüčÅ ą▓ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąŠčüčéč¢.
ąÆą╗ą░čüčéąĖą▓ąŠčüčéč¢ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā. ąæąĄąĘą▒ą░čĆą▓ąĮąĖą╣ ą▓ą░ąČą║ąĖą╣ ą│ą░ąĘ ąĘ ą│ąŠčüčéčĆąĖą╝ ąĘą░ą┐ą░čģąŠą╝, čēąŠ ą▓ąĖą║ą╗ąĖą║ą░čö ą║ą░čłąĄą╗čī. ąŚčĆč¢ą┤ąČčāčöčéčīčüčÅ ą┐čĆąĖ -10*ąĪ. ąĮąĄą│ąŠčĆčÄčćąĖą╣; ą┤ąŠą▒čĆąĄ čĆąŠąĘčćąĖąĮčÅčöčéčīčüčÅ čā ą▓ąŠą┤č¢. ąŻ čĆąŠąĘčćąĖąĮč¢, SO2 ą╗ąĄą│ą║ąŠ ąŠą║ąĖčüąĮčÄčöčéčīčüčÅ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ą║ą░ą╗č¢ą╣ ą┐ąĄčĆą╝ą░ąĮą│ą░ąĮą░č鹊ą╝ (čłą▓ąĖą┤ą║ąŠ) ą░ą▒ąŠ ą║ąĖčüąĮąĄą╝ ą┐ąŠą▓č¢čéčĆčÅ (ą┐ąŠą▓č¢ą╗čīąĮąŠ), ą┤ąŠ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ H2SO4:
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2SO2 + O2 + 2H2O = 2H2SO4
ąĪčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ ą┤č¢čö čÅą║ ą▓č¢ą┤ą▒č¢ą╗čÄčÄčćąĖą╣ ą░ą│ąĄąĮčé ąĮą░ ą▒ą░ą│ą░č鹊 ą▒ą░čĆą▓ąĮąĖą║č¢ą▓; ąĮą░ ą▓č¢ą┤ą╝č¢ąĮčā ą▓č¢ą┤ ąĮąĄąĘą▓ąŠčĆąŠčéąĮąŠčŚ ą┤č¢čŚ ą▒č¢ą╗ąĖą╗čīąĮąŠą│ąŠ ą▓ą░ą┐ąĮą░, ąĘąĮąĄą▒ą░čĆą▓ą╗ąĄąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ąŠą╝ ą╝ąŠąČąĮą░ ąĘčāą┐ąĖąĮąĖčéąĖ, č¢ ąĘą░ą▒ą░čĆą▓ą╗ąĄąĮąĮčÅ ą┐ąŠą▓ąĄčĆčéą░čöčéčīčüčÅ ą┐č¢čüą╗čÅ ą┐čĆąŠą╝ąĖą▓ą░ąĮąĮčÅ.
ąŚą░čüč鹊čüčāą▓ą░ąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā. SO2 – ą┐čĆąŠą╝č¢ąČąĮąĖą╣ ą┐čĆąŠą┤čāą║čé čā ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓č¢ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ čéą░ č¢ąĮčłąĖčģ čüą┐ąŠą╗čāą║ čüčāą╗čīčäčāčĆčā. ąÆąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą┤ą╗čÅ ą▓č¢ą┤ą▒č¢ą╗čÄą▓ą░ąĮąĮčÅ ą┐ą░ą┐ąĄčĆčā, čüąŠą╗ąŠą╝ąĖ č¢ ą▓ąŠą▓ąĮąĖ, ą┐čĆąĖ ąŠą▒čĆąŠą▒čåč¢ ą▓ąĖąĮąĮąĖčģ ą▒ąŠč湊ą║, ą┤ą╗čÅ čüčāą╗čīč乊čģą╗ąŠčĆčāą▓ą░ąĮąĮčÅ ąĮą░čüąĖč湥ąĮąĖčģ ą▓čāą│ą╗ąĄą▓ąŠą┤ąĮč¢ą▓. ąĀč¢ą┤ą║ąĖą╣ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ ąĘą░čüč鹊čüąŠą▓čāčÄčéčī ą┤ą╗čÅ ąŠčćąĖčēąĄąĮąĮčÅ ąĮą░čäčéąĖ.
ąĪčāą╗čīčäč¢čéąĖ
ą¤čĆąĖ čĆąŠąĘčćąĖąĮąĄąĮąĮč¢ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā čā ą▓ąŠą┤č¢ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą║ąĖčüą╗ąŠčéąĮąĖą╣ ą┐ąŠą╗č¢ą│č¢ą┤čĆą░čé SO2*nH2O, čÅą║ąĖą╣ čĆą░ąĮč¢čłąĄ ąĘąŠą▒čĆą░ąČčāą▓ą░ą╗ąĖ čāą╝ąŠą▓ąĮąŠčÄ č乊čĆą╝čāą╗ąŠčÄ H2SO3 (ąĮą░čüą┐čĆą░ą▓ą┤č¢, ą╝ąŠą╗ąĄą║čāą╗ąĖ H2SO3 ąĮąĄą▓č¢ą┤ąŠą╝č¢) č¢ ąĮą░ąĘąĖą▓ą░ą╗ąĖ čüč¢čĆčćąĖčüčéą░ ą║ąĖčüą╗ąŠčéą░. ą¤ąŠą╗č¢ą│č¢ą┤čĆą░čé SO2*nH2O ą▓ ą▓ąŠą┤ąĮąŠą╝čā čĆąŠąĘčćąĖąĮč¢ čö ą║ąĖčüą╗ąŠč鹊čÄ čüąĄčĆąĄą┤ąĮčīąŠčŚ čüąĖą╗ąĖ; ą┐čĆąĖ ąĮąĄą╣čéčĆą░ą╗č¢ąĘą░čåč¢čŚ čåčīąŠą│ąŠ čĆąŠąĘčćąĖąĮčā čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ čüčāą╗čīčäč¢čéąĖ.
ąŚą░ą│ą░ą╗čīąĮą░ č乊čĆą╝čāą╗ą░ čüąĄčĆąĄą┤ąĮč¢čģ čüčāą╗čīčäč¢čéč¢ą▓ Me2SO3, ą║ąĖčüą╗ąĖčģ čüčāą╗čīčäč¢čéč¢ą▓ (ą│č¢ą┤čĆąŠčüčāą╗čīčäč¢čéč¢ą▓) MeHSO3.
ąŻ ą▓ąŠą┤č¢ čĆąŠąĘčćąĖąĮąĮč¢ čéč¢ą╗čīą║ąĖ čüčāą╗čīčäč¢čéąĖ ą╗čāąČąĮąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓, ą┐čĆąĖ ą║ąĖą┐’čÅčéč¢ąĮąĮč¢ čĆąŠąĘčćąĖąĮč¢ą▓ čåąĖčģ čüčāą╗čīčäč¢čéč¢ą▓ ąĘ čüč¢čĆą║ąŠčÄ ą▓ąŠąĮąĖ ą┐ąĄčĆąĄčģąŠą┤čÅčéčī čā ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮč¢ čéč¢ąŠčüčāą╗čīčäą░čéąĖ. ąÆčüč¢ čüčāą╗čīčäč¢čéąĖ ą┐č¢ą┤ ą┤č¢čöčÄ čüąĖą╗čīąĮąĖčģ ą║ąĖčüą╗ąŠčé čĆąŠąĘą║ą╗ą░ą┤ą░čÄčéčīčüčÅ ąĘ ą▓ąĖą┤č¢ą╗ąĄąĮąĮčÅą╝ SO2.
ąöąŠ ąĮą░ą╣ą▓ą░ąČą╗ąĖą▓č¢čłąĖčģ čüčāą╗čīčäč¢čéč¢ą▓ ą▓č¢ą┤ąĮąŠčüčÅčéčīčüčÅ ąĮą░čéčĆč¢ą╣ čüčāą╗čīčäč¢čé Na2SO3 č¢ ąĮą░čéčĆč¢ą╣ ą│č¢ą┤čĆąŠčüčāą╗čīčäč¢čé NaHSO3. ąĀąŠąĘčćąĖąĮ ą║ą░ą╗čīčåč¢ą╣ ą│č¢ą┤čĆąŠčüčāą╗čīčäč¢čéčā Ca(HSO3)2, čÅą║ąĖą╣ ąĮą░ąĘąĖą▓ą░čÄčéčī “čüčāą╗čīčäč¢čéąĮąĖą╣ ą╗čāą│“, ąŠčéčĆąĖą╝čāčÄčéčī ąĘ ą║ą░ą╗čīčåč¢ą╣ ą║ą░čĆą▒ąŠąĮą░čéčā (ą▓ą░ą┐ąĮčÅą║čā), čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā čéą░ ą▓ąŠą┤ąĖ; ą╣ąŠą│ąŠ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą╗č¢ą│ąĮč¢ąĮčā ąĘ ą┤ąĄčĆąĄą▓ąĖąĮąĖ ą┐čĆąĖ ąŠčéčĆąĖą╝ą░ąĮąĮč¢ čåąĄą╗čÄą╗ąŠąĘąĖ.
ąöąĖčüčāą╗čīčäč¢čéąĖ MeI2S2O5 – ą┐ąŠčģč¢ą┤ąĮč¢ ą▓č¢ą┤ ąĮąĄą▓č¢ą┤ąŠą╝ąŠčŚ čā ą▓č¢ą╗čīąĮąŠą╝čā ą▓ąĖą│ą╗čÅą┤č¢ ą┤č¢čüąĄčĆąĮč¢čüčéąŠčŚ ą║ąĖčüą╗ąŠčéąĖ H2S2O5; čåč¢ čüąŠą╗č¢ (čĆą░ąĮč¢čłąĄ ąĮą░ąĘąĖą▓ą░ą╗ąĖčüčÅ ą┐č¢čĆąŠčüčāą╗čīčäč¢čéąĖ ą░ą▒ąŠ ą╝ąĄčéą░ą▒č¢čüčāą╗čīčäč¢čéąĖ) ą╝ąŠąČąĮą░ ąŠčéčĆąĖą╝ą░čéąĖ ą┐čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ ą│č¢ą┤čĆąŠčüčāą╗čīčäč¢čéč¢ą▓, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤:
2KHSO3 = K2S2O5 + H2O
ąÜą░ą╗č¢ą╣ ą┤ąĖčüčāą╗čīčäč¢čé K2S2O5 ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą▓ č乊č鹊ą│čĆą░čäč¢čÅčģ, čÅą║ ą┐čĆąŠčÅą▓ąĮąĖą║ č¢ ąĘą░ą║čĆč¢ą┐ą╗čÄą▓ą░čć.
ąĪčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤ SO3
ą×čéčĆąĖą╝ą░ąĮąĮčÅ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤čā. ąÜą░čéą░ą╗č¢čéąĖčćąĮąĄ ąŠą║ąĖčüąĮąĄąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā; ą▓č¢ą┤ą│ąŠąĮą║ą░ ąĘ ąŠą╗ąĄčāą╝čā; č鹥čĆą╝č¢čćąĮąĖą╣ čĆąŠąĘą║ą╗ą░ą┤ K2S2O7 ąĮą░ K2SO4 č¢ SO3 (ą╗ą░ą▒ąŠčĆą░č鹊čĆąĮąĖą╣ čüą┐ąŠčüč¢ą▒).
ąÆą╗ą░čüčéąĖą▓ąŠčüčéč¢ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤čā. ąÆč¢ą┤ąŠą╝č¢ čéčĆąĖ ą░ą╗ąŠčéčĆąŠą┐ąĮč¢ ą╝ąŠą┤ąĖčäč¢ą║ą░čåč¢čŚ SO3. ąØą░ą╣ą▒č¢ą╗čīčł čüčéč¢ą╣ą║ą░ ą░ą╗ąŠčéčĆąŠą┐ąĮą░ ą╝ąŠą┤ąĖčäč¢ą║ą░čåč¢čÅ ╬▒-SO3 čāčéą▓ąŠčĆčÄčöčéčīčüčÅ čā ą▓ąĖą│ą╗čÅą┤č¢ čłąŠą▓ą║ąŠą▓ąŠ-ą▒ą╗ąĖčüą║čāčćąĖčģ ą│ąŠą╗ąŠą║, čÅą║č¢ ąĮą░ ą┐ąŠą▓č¢čéčĆč¢ čĆč¢ąĘą║ąŠ čéčģąĮčāčéčī. ąóąĄą╝ą┐ąĄčĆą░čéčāčĆą░ ą┐ą╗ą░ą▓ą╗ąĄąĮąĮčÅ ╬▒-SO3 40*ąĪ. ąåąĮč鹥ąĮčüąĖą▓ąĮąŠ čĆąĄą░ą│čāčö ąĘ ą▓ąŠą┤ąŠčÄ čāčéą▓ąŠčĆčÄčÄčćąĖ čüčāą╗čīčäą░čéąĮčā ą║ąĖčüą╗ąŠčéčā. ąĪčģąŠąČą░ ąĮą░ ą╗č¢ą┤ ą░ą╗ąŠčéčĆąŠą┐ąĮą░ ą╝ąŠą┤ąĖčäč¢ą║ą░čåč¢čÅ – ╬│-SO3 ą╝ą░čö č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą┐ą╗ą░ą▓ą╗ąĄąĮąĮčÅ 16,8*ąĪ č¢ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą║ąĖą┐č¢ąĮąĮčÅ 44,8*ąĪ.
ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ H2SO4
ą×čéčĆąĖą╝ą░ąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąÆąĖą┤č¢ą╗ąĄąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘ čüčāą╗čīčäą░čéč¢ą▓ ąĘą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ čüąĖą╗čīąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘ ą┐ąŠą┤ą░ą╗čīčłąĖą╝ ą▓ąĖą┐ą░čĆąŠą▓čāą▓ą░ąĮąĮčÅą╝ H2SO4 ąĮąĄą╝ąŠąČą╗ąĖą▓ąŠ, ąŠčüą║č¢ą╗čīą║ąĖ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ čüą░ą╝ą░ ą┐ąŠ čüąŠą▒č¢ čö čüąĖą╗čīąĮą░ ą║ąĖčüą╗ąŠčéą░ č¢ ą▓ąĖčēąĄ 300*ąĪ čĆąŠąĘą║ą╗ą░ą┤ą░čöčéčīčüčÅ. ąÆčüč¢ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓č¢ ą╝ąĄč鹊ą┤ąĖ čüąĖąĮč鹥ąĘčā čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘą░čüąĮąŠą▓ą░ąĮč¢ ąĮą░
- ą×čéčĆąĖą╝ą░ąĮąĮč¢ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā SO2;
- ą×ą║ąĖčüąĮąĄąĮąĮč¢ SO2 ą▓ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤ SO3;
- ąÆąĘą░čöą╝ąŠą┤č¢čŚ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤čā ąĘ ą▓ąŠą┤ąŠčÄ.
I čüčéą░ą┤č¢čÅ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ H2SO4: ąŠčéčĆąĖą╝ą░ąĮąĮčÅ SO2
ą¤ąĄčĆčłčā čüčéą░ą┤č¢čÄ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ – ąŠčéčĆąĖą╝ą░ąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā – ą╝ąŠąČąĮą░ ą▓ąĄčüčéąĖ čéčĆčīąŠą╝ą░ čüą┐ąŠčüąŠą▒ą░ą╝ąĖ:
- ąÆąĖą┐ą░ą╗ čüčāą╗čīčäč¢ą┤ąĮąĖčģ čĆčāą┤ (ąĮą░ą╣ą▒č¢ą╗čīčł ą┐ąŠčłąĖčĆąĄąĮąĖą╣ čüą┐ąŠčüč¢ą▒), ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą┐č¢čĆąĖčéčā. ą¤čĆąŠčåąĄčü ą┐čĆąŠą▓ąŠą┤čÅčéčī ą▓ čéčĆčāą▒čćą░čüčéąĖčģ ąŠą▒ąĄčĆč鹊ą▓ąĖčģ ą░ą▒ąŠ ą╝ąĮąŠą│ąŠą┐ąŠą┤ąŠą▓ąĖčģ ą┐ąĄčćą░čģ, ą░ čéą░ą║ąŠąČ ą▓ ą┐ąĄčćą░čģ ąĘ ą║ąĖą┐ą╗čÅčćąĖą╝ čłą░čĆąŠą╝. ąóąĄčģąĮąŠą╗ąŠą│č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ ą║ąŠą╗čīąŠčĆąŠą▓ąŠčŚ ą╝ąĄčéą░ą╗čāčĆą│č¢čŚ ąĘą░ą▓ąČą┤ąĖ čüčāą┐čĆąŠą▓ąŠą┤ąČčāčÄčéčīčüčÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅą╝ H2SO4, ąŠčüą║č¢ą╗čīą║ąĖ ą┐čĆąĖ ą▓ąĖą┐ą░ą╗čÄą▓ą░ąĮąĮč¢ čüčāą╗čīčäč¢ą┤ąĮąĖčģ čĆčāą┤ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤.
- ąÆč¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą│č¢ą┐čüčā ą░ą▒ąŠ ą░ąĮą│č¢ą┤čĆąĖčéčā. ąōč¢ą┐čü ą░ą▒ąŠ ą░ąĮą│č¢ą┤čĆąĖčé ąĮą░ą│čĆč¢ą▓ą░čÄčéčī čā ą┐ąĄčćč¢, čēąŠ ąŠą▒ąĄčĆčéą░čöčéčīčüčÅ (ąĘ čĆąŠąĘą╝č¢čĆą░ą╝ąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ą┤ąŠą▓ąČąĖąĮą░ 80 ą╝ąĄčéčĆč¢ą▓, ą┤č¢ą░ą╝ąĄčéčĆ 2-3 ą╝ąĄčéčĆąĖ) ą┐čĆąĖ 1400*ąĪ ąĘ ą║ąŠą║čüąŠą▓ąĖą╝ ą▓č¢ą┤čüč¢ą▓ąŠą╝, ą┐č¢čüą║ąŠą╝ č¢ ą│ą╗ąĖąĮąŠčÄ: ąĮąĄąŠą▒čģč¢ą┤ąĮą░ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░ čüčéą▓ąŠčĆčÄčöčéčīčüčÅ ąĘą│ąŠčĆčÅąĮąĮčÅą╝ ą▓čāą│č¢ą╗čīąĮąŠą│ąŠ ą┐ąĖą╗čā:
2CaSO4 + C ŌåÆ 2CaO + 2SO2 + CO2
CaO + SiO2 + ą░ą╗čÄą╝ąŠčüąĖą╗č¢ą║ą░čé ŌåÆ ąÜą░ą╗čīčåč¢ą╣ ą░ą╗čÄą╝ąŠčüąĖą╗č¢ą║ą░čé
(ą┐č¢čüąŠą║) + (ą│ą╗ąĖąĮą░) ŌåÆ (čåąĄą╝ąĄąĮčé)
ąóą▓ąĄčĆą┤ąĖą╣ ąĘą░ą╗ąĖčłąŠą║ ą▓č¢ą┤ čåčīąŠą│ąŠ ą┐čĆąŠčåąĄčüčā ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą┤ą╗čÅ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ čåąĄą╝ąĄąĮčéčā.
- ąĪą┐ą░ą╗čÄą▓ą░ąĮąĮčÅ čüč¢čĆą║ąĖ:
S + O2 = SO2
II čüčéą░ą┤č¢čÅ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ H2SO4: ąŠą║ąĖčüąĮąĄąĮąĮčÅ SO2 ą▓ SO3
ąöčĆčāą│ą░ čüčéą░ą┤č¢čÅ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ – ąŠą║ąĖčüąĮąĄąĮąĮčÅ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā; čåąĄą╣ ą┐čĆąŠčåąĄčü ą┐čĆąŠą▓ąŠą┤čÅčéčī ą║ąŠąĮčéą░ą║čéąĮąĖą╝ ą░ą▒ąŠ ąĮč¢čéčĆąŠąĘąĮąĖą╝ čüą┐ąŠčüąŠą▒ąŠą╝.
ąÜąŠąĮčéą░ą║čéąĮąĖą╣ čüą┐ąŠčüč¢ą▒ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ ą▓ąĖą│ąŠč鹊ą▓ą╗ąĄąĮąĮčÅ, ą┐čĆąĖą▒ą╗ąĖąĘąĮąŠ 80% ą▓č¢ą┤ čüą▓č¢č鹊ą▓ąŠą│ąŠ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ H2SO4. ąĪą┐ąŠčüč¢ą▒ ą▓č¢ą┤ąŠą╝ąĖą╣ ąĘ 1900 čĆąŠą║čā. ą¤čĆąŠą┤čāą║č鹊ą╝ čö ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ H2SO4.
ąĪčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤, ąŠčćąĖčēąĄąĮąĖą╣ ą▓č¢ą┤ ą║ąŠąĮčéą░ą║čéąĮąĖčģ ąŠčéčĆčāčé, ąĘąŠą║čĆąĄą╝ą░ čüą┐ąŠą╗čāą║ ą░čĆčüąĄąĮčā, č¢ ą▓č¢ą┤ ą╝ąĄčģą░ąĮč¢čćąĮąĖčģ ą┤ąŠą╝č¢čłąŠą║, čłą╗čÅčģąŠą╝ ą┐čĆąŠą╝ąĖą▓ą░ąĮąĮčÅ ą▓ čüą┐ąĄčåč¢ą░ą╗čīąĮąĖčģ ą▓ąĄąČą░čģ, ą░ ą┐ąŠčéč¢ą╝ ą▓ąŠą╗ąŠą│č¢ą╣ čéą░ čüčāčģč¢ą╣ ąĄą╗ąĄą║čéčĆąŠčäč¢ą╗čīčéčĆą░čåč¢čŚ, ąĘą▒ą░ą│ą░čćčāčÄčéčī ą║ąĖčüąĮąĄą╝ č¢ ą┐čĆąŠą┐čāčüą║ą░čÄčéčī ąĮą░ą┤ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆąŠą╝ – ą▓ą░ąĮą░ą┤č¢ą╣(V) ąŠą║čüąĖą┤ąŠą╝ V2O5 ą░ą▒ąŠ ą┐ą╗ą░čéąĖąĮąŠą▓ą░ąĮąĖą╝ ą░ąĘą▒ąĄčüč鹊ą╝. ąĪčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐ąŠ čĆąĄą░ą║čåč¢čŚ:
2SO2 + O2 Ōćä 2SO3
ąÆąĖčģč¢ą┤ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤čā čüčéą░ąĮąŠą▓ąĖčéčī 99% SO3 (ą▒č¢ą╗ąĖą╣ čéčāą╝ą░ąĮ). ąŻ ą▒ą░čłč鹊ą▓ąŠą╝čā ą░ą▒čüąŠčĆą▒ąĄčĆč¢ SO3 čĆąĄą░ą│čāčö ąĘ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčÄ H2SO4 ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą┤ąĖčüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ H2S2O7. ąŚ čåč¢čöčŚ ą║ąĖčüą╗ąŠčéąĖ čłą╗čÅčģąŠą╝ ą║ąŠąĮčéčĆąŠą╗čīąŠą▓ą░ąĮąŠą│ąŠ čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮąĮčÅ ą▓ąŠą┤ąŠčÄ ąŠčéčĆąĖą╝čāčÄčéčī ą░ą▒ąŠ čćąĖčüčéčā (ą▒ąĄąĘą▒ą░čĆą▓ąĮčā 100%) H2SO4, ą░ą▒ąŠ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮč¢ ą▓ąŠą┤ąĮč¢ čĆąŠąĘčćąĖąĮąĖ H2SO4.
ąØč¢čéčĆąŠąĘąĮąĖą╣ čüą┐ąŠčüč¢ą▒ (ą▒ą░čłč鹊ą▓ąĖą╣ čüą┐ąŠčüč¢ą▒ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ, ą║ą░ą╝ąĄčĆąĮąĖą╣ čüą┐ąŠčüč¢ą▒) ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī, ą┤ą╗čÅ ą▓ąĖą│ąŠč鹊ą▓ą╗ąĄąĮąĮčÅ, ą┐čĆąĖą▒ą╗ąĖąĘąĮąŠ 20% ą▓č¢ą┤ čüą▓č¢č鹊ą▓ąŠą│ąŠ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░ H2SO4. ąĪą┐ąŠčüč¢ą▒ ą▓č¢ą┤ąŠą╝ąĖą╣ ą┐čĆąĖą▒ą╗ąĖąĘąĮąŠ ą▓ 1750 čĆąŠą║čā. ą¤čĆąŠą┤čāą║č鹊ą╝ čö ą╝ąĄąĮčł ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ H2SO4, ąĮč¢ąČ ą▓ ą║ąŠąĮčéą░ą║čéąĮąŠą╝čā čüą┐ąŠčüąŠą▒č¢.
ąĪčģąĄą╝ą░ ąĮč¢čéčĆąŠąĘąĮąŠą│ąŠ čüą┐ąŠčüąŠą▒čā ą▓ąĖą│ąŠč鹊ą▓ą╗ąĄąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ.
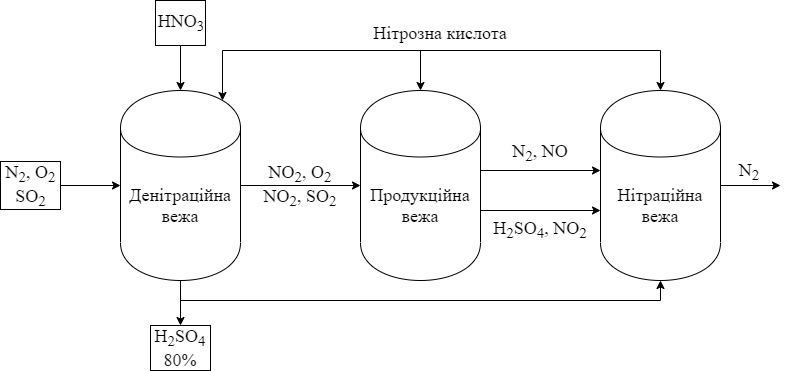
ą¤ąŠą▓č¢čéčĆčÅ, čēąŠ ą╝č¢čüčéąĖčéčī SO3 ą┐čĆąŠčģąŠą┤ąĖčéčī č湥čĆąĄąĘ ą┤ąĄąĮč¢čéčĆą░čåč¢ą╣ąĮčā ą▓ąĄąČčā ą┐čĆąĖ 100*ąĪ, ą┤ąĄ ąĮč¢čéčĆąŠąĘč¢ą╗čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ SO2(OH)(O-NO) – čåąĄ ą│ąŠą╗ąŠą▓ąĮą░ čüą║ą╗ą░ą┤ąŠą▓ą░ čćą░čüčéąĖąĮą░ ąĮč¢čéčĆąŠąĘąĮąĖčģ ą║ąĖčüą╗ąŠčé, čÅą║č¢ ąĮą░ą┤čģąŠą┤čÅčéčī ą▓ čåčÄ ą▓ąĄąČčā – ą┐ąĄčĆąĄčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓ 80% H2SO4. ąØą░ ą▓ąĖčģąŠą┤č¢ – ą│ą░ąĘąŠą┐ąŠą┤č¢ą▒ąĮčā čüčāą╝č¢čł NO2, SO2 č¢ ą┐ąŠą▓č¢čéčĆčÅ ą┐čĆąŠą┐čāčüą║ą░čÄčéčī č湥čĆąĄąĘ ą┐čĆąŠą┤čāą║čåč¢ą╣ąĮčā ą▓ąĄąČčā (čĆą░ąĮč¢čłąĄ čåąĄ ą▒čāą╗ąĖ ą┐ąŠą║čĆąĖčéč¢ ąĘčüąĄčĆąĄą┤ąĖąĮąĖ čüą▓ąĖąĮčåąĄą▓č¢ ą║ą░ą╝ąĄčĆąĖ), ą║čāą┤ąĖ čéą░ą║ąŠąČ ą┐ąŠą┤ą░čÄčéčī ąĮč¢čéčĆąŠąĘąĮč¢ ą║ąĖčüą╗ąŠčéąĖ. ąÆč¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐ąŠą▓ąĮąĄ ąŠą║ąĖčüąĮąĄąĮąĮčÅ SO2:
SO2 + NO2 = SO3 + NO; 2NO + O2 = 2NO2
ąŻčéą▓ąŠčĆąĄąĮąĖą╣ SO3 čĆąĄą░ą│čāčö ąĘ ą▓ąŠą┤ąŠčÄ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąĪčāą╝č¢čł H2SO4, NO, NO2 č¢ N2 ą┐ąŠą┤ą░čÄčéčī ą▓ ąĮč¢čéčĆą░čåč¢ą╣ąĮčā ą▓ąĄąČčā, ą┤ąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ čüąĖąĮč鹥ąĘ ąĮč¢čéčĆąŠąĘąĮąĖčģ ą║ąĖčüą╗ąŠčé ąĘ H2SO4, NO č¢ NO2. ąöą╗čÅ ą┐ąŠą┐ąŠą▓ąĮąĄąĮąĮčÅ ą▓čéčĆą░č湥ąĮąĖčģ ąĮč¢čéčĆąŠąĘąĮąĖčģ ą│ą░ąĘč¢ą▓ ą▓ ą┤ąĄąĮč¢čéčĆą░čåč¢ąĮčā ą▓ąĄąČčā ą▓ą▓ąŠą┤čÅčéčī ąĮč¢čéčĆą░čéąĮčā ą║ąĖčüą╗ąŠčéčā.
ążč¢ąĘąĖčćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ – ą▒ąĄąĘą▒ą░čĆą▓ąĮą░ ą╝ą░čüą╗ąŠą┐ąŠą┤č¢ą▒ąĮą░ čĆč¢ą┤ąĖąĮą░ ą▒ąĄąĘ ąĘą░ą┐ą░čģčā, čēč¢ą╗čīąĮč¢čüčéčī 1,84 ą│./čüą╝3 ą┐čĆąĖ 20*ąĪ. ą¤čĆąĖ 338*ąĪ ąĘą░ą║ąĖą┐ą░čö, čāčéą▓ąŠčĆčÄčÄčćąĖ čéčāą╝ą░ąĮ SO3. ą¤čĆąĖ čĆąŠąĘą▓ąĄą┤ąĄąĮąĮč¢ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ą▓ąŠą┤ąŠčÄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ čüąĖą╗čīąĮąĄ čĆąŠąĘč¢ą│čĆč¢ą▓ą░ąĮąĮčÅ (čāčéą▓ąŠčĆąĄąĮąĮčÅ ą│č¢ą┤čĆą░čéč¢ą▓, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ H2SO4*H2O), čēąŠ čüčāą┐čĆąŠą▓ąŠą┤ąČčāčöčéčīčüčÅ čĆąŠąĘą▒čĆąĖąĘą║čāą▓ą░ąĮąĮčÅą╝ čĆč¢ą┤ąĖąĮąĖ.
ą¤čĆą░ą▓ąĖą╗ąŠ čĆąŠąĘą▓ąĄą┤ąĄąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ: čüą╗č¢ą┤ ą▓ą╗ąĖą▓ą░čéąĖ ą┐čĆąĖ ą┐ąĄčĆąĄą╝č¢čłčāą▓ą░ąĮąĮč¢ ą║ąĖčüą╗ąŠčéčā ą▓ ą▓ąŠą┤čā, ą░ ąĮąĄ ąĮą░ą▓ą┐ą░ą║ąĖ!
ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ą┤čāąČąĄ ą│č¢ą│čĆąŠčüą║ąŠą┐č¢čćąĮą░ č¢ č鹊ą╝čā ą┐čĆąĖą┤ą░čéąĮą░ ą┤ą╗čÅ ąŠčüčāčłąĄąĮąĮčÅ ą▒ą░ą│ą░čéčīąŠčģ ą│ą░ąĘč¢ą▓ (ą░ą╗ąĄ ąĮąĄ ą░ą╝ąŠąĮč¢ą░ą║čā!).
ąźč¢ą╝č¢čćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąöčāąČąĄ čüąĖą╗čīąĮą░ ą┤ą▓čāčģąŠčüąĮąŠą▓ąĮą░ ą║ąĖčüą╗ąŠčéą░, ą▓ąČąĄ ą┐čĆąĖ ą┐ąŠą╝č¢čĆąĮąŠą╝čā čĆąŠąĘą▓ąĄą┤ąĄąĮąĮč¢ ą┐čĆą░ą║čéąĖčćąĮąŠ ą┐ąŠą▓ąĮč¢čüčéčÄ ą┤ąĖčüąŠčåč¢čÄčö ąĮą░ č¢ąŠąĮąĖ H+ (H3O+) č¢ SO42-:
H2SO4 + 2H2O┬Ā = SO42- + 2H3O+
ąōč¢ą┤čĆąŠčüčāą╗čīčäą░čé-č¢ąŠąĮąĖ HSO4– č¢čüąĮčāčÄčéčī čéč¢ą╗čīą║ąĖ ą▓ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąĖčģ čĆąŠąĘčćąĖąĮą░čģ H2SO4:
H2SO4 + H2O Ōćä HSO4– + H3O+
ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ąĮąĄą╗ąĄčéą║ą░ č¢ ą▓ąĖčéč¢čüąĮčÅčö ą▒ą░ą│ą░č鹊 č¢ąĮčłąĖčģ ą║ąĖčüą╗ąŠčé ąĘ čŚčģ čüąŠą╗ąĄą╣, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤:
CaF2 + H2SO4 = CaSO4 + 2HF
2Na(CH3COO) + H2SO4 = Na2SO4 + 2CH3COOH
ąÜąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░, ąŠčüąŠą▒ą╗ąĖą▓ąŠ ą│ą░čĆčÅčćą░, – ąĄąĮąĄčĆą│č¢ą╣ąĮąĖą╣ ąŠą║ąĖčüąĮčÄą▓ą░čć. ąÆąŠąĮą░ ąŠą║ąĖčüąĮčÄčö HI, HBr (ą░ą╗ąĄ ąĮąĄ HCl) ą┤ąŠ ą▓č¢ą╗čīąĮąĖčģ ą│ą░ą╗ąŠą│ąĄąĮč¢ą▓, ą▓čāą│č¢ą╗ą╗čÅ – ą┤ąŠ CO2, čüč¢čĆą║čā – ą┤ąŠ SO2:
8HI + H2SO4 = 4I2 + H2S + 4H2O
2HBr + H2SO4 = Br2 + SO2 + 2H2O
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
S + H2SO4 = 3SO2 + 2H2O
ąÆąĘą░čöą╝ąŠą┤č¢čÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘ ą╝ąĄčéą░ą╗ą░ą╝ąĖ ą┐čĆąŠčéč¢ą║ą░čö ą┐ąŠ-čĆč¢ąĘąĮąŠą╝čā ą▓ ąĘą░ą╗ąĄąČąĮąŠčüčéč¢ ą▓č¢ą┤ čŚčŚ ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čŚ č¢ ą░ą║čéąĖą▓ąĮąŠčüčéč¢ ą╝ąĄčéą░ą╗čā. ąĀąŠąĘą▒ą░ą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗčüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ą┤ąĖčüąŠčåč¢čÄčö ąĮą░ č¢ąŠąĮąĖ č¢ ąŠą║ąĖčüąĮčÄčö č¢ąŠąĮąŠą╝ ąŠą║čüąŠąĮč¢čÄ H3O+ ą╝ąĄčéą░ą╗ąĖ, čēąŠ čüč鹊čÅčéčī ą▓ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮąŠą╝čā čĆčÅą┤č¢ ąĮą░ą┐čĆčāą│ ą┤ąŠ ą│č¢ą┤čĆąŠą│ąĄąĮčā (ąĘ ą╝ąĄčéą░ą╗ą░ą╝ąĖ, čēąŠ čüč鹊čÅčéčī ą┐č¢čüą╗čÅ ą│č¢ą┤čĆąŠą│ąĄąĮčā čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗčüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ąĮąĄ čĆąĄą░ą│čāčö):
Zn + H2SO4 (čĆąŠąĘą▒.) = ZnSO4 + H2
ąĪą▓ąĖąĮąĄčåčī ą▓ čüčāą╗čīčäą░čéąĮč¢ą╣ ą║ąĖčüą╗ąŠčéč¢ ąĮąĄ čĆąŠąĘčćąĖąĮčÅčöčéčīčüčÅ, ąŠčüą║č¢ą╗čīą║ąĖ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐čĆąĖ ą║ąŠąĮčéą░ą║čéč¢ ąĘ čüčāą╗čīčäą░čéąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ ąĮąĄčĆąŠąĘčćąĖąĮąĮą░ ą┐ą╗č¢ą▓ą║ą░ PbSO4, čÅą║ą░ ąĘą░čģąĖčēą░čö ą╝ąĄčéą░ą╗ – ą┐ą░čüčüąĖą▓ą░čåąĖčÅ.
ąÜąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ čö ąŠą║ąĖčüąĮčÄą▓ą░č湥ą╝ ąĘą░ čĆą░čģčāąĮąŠą║ ą░č鹊ą╝ą░ čüčāą╗čīčäčāčĆ(VI). ą”ąĄ ą┐ąŠčÅčüąĮčÄčöčéčīčüčÅ, čéąĖą╝, čēąŠ ąĘč¢ ąĘą▒č¢ą╗čīčłąĄąĮąĮčÅą╝ ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ, ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čÅ č¢ąŠąĮč¢ą▓ ąŠą║čüąŠąĮč¢čÄ H3O+ ąĘą╝ąĄąĮčłčāčöčéčīčüčÅ, č¢ ą▓ 100% čüčāą╗čīčäą░čéąĮč¢ą╣ ą║ąĖčüą╗ąŠčéč¢ H3O+ ą┐čĆą░ą║čéąĖčćąĮąŠ ą▓č¢ą┤čüčāčéąĮč¢, č鹊ą╝čā č¢ ą┐čĆąŠčÅą▓ą╗čÅčÄčéčīčüčÅ ąŠą║ąĖčüąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘą░ čĆą░čģčāąĮąŠą║ ą░č鹊ą╝ą░ S+VI. ąÜąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ąŠą║ąĖčüąĮčÄčö ą╝ąĄčéą░ą╗ąĖ, čÅą║č¢ čüč鹊čÅčéčī ą▓ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮąŠą╝čā čĆčÅą┤č¢ ąĮą░ą┐čĆčāą│ ą┤ąŠ ą░čĆą│ąĄąĮčéčāą╝čā ą▓ą║ą╗čÄčćąĮąŠ. ą¤čĆąŠą┤čāą║čéąĖ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ą╝ąŠąČčāčéčī ą▒čāčéąĖ čĆč¢ąĘąĮąĖą╝ąĖ ą▓ ąĘą░ą╗ąĄąČąĮąŠčüčéč¢ ą▓č¢ą┤ ą░ą║čéąĖą▓ąĮąŠčüčéč¢ ą╝ąĄčéą░ą╗čā č¢ ą▓č¢ą┤ čāą╝ąŠą▓ čĆąĄą░ą║čåč¢čŚ (čüčéčāą┐č¢ąĮčī ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čŚ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ č¢ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░). ą¤čĆąĖ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘ ą╝ą░ą╗ąŠą░ą║čéąĖą▓ąĮąĖą╝ąĖ ą╝ąĄčéą░ą╗ą░ą╝ąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ąĘ ą╝č¢ą┤ą┤čÄ, ą║ąĖčüą╗ąŠčéą░ ą▓č¢ą┤ąĮąŠą▓ą╗čÄčöčéčīčüčÅ ą┤ąŠ SO2:
Cu + 2H2SO4 (ą║ąŠąĮčå.) = CuSO4 + SO2 + 2H2O
ą¤čĆąĖ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčŚ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘ ą▒č¢ą╗čīčł ą░ą║čéąĖą▓ąĮąĖą╝ąĖ ą╝ąĄčéą░ą╗ą░ą╝ąĖ ą┐čĆąŠą┤čāą║čéą░ą╝ąĖ ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ ą╝ąŠąČčāčéčī ą▒čāčéąĖ čÅą║ SO2 čéą░ą║ č¢ S č¢ H2S:
Zn + 2H2SO4 (ą║ąŠąĮčå.) = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 (ą║ąŠąĮčå.) = 2ZnSO4 + S + 4H2O
4Zn + 5H2SO4 (ą║ąŠąĮčå.) = 4ZnSO4 + H2S + 4H2O
ą×čüąŠą▒ą╗ąĖą▓ąĖą╝ čćąĖąĮąŠą╝ čĆąĄą░ą│čāčö č¢ąĘ čüčāą╗čīčäą░čéąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ ąĘą░ą╗č¢ąĘąŠ. ąÆ čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮąĖčģ čĆąŠąĘčćąĖąĮą░čģ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ, ąĘą░ą╗č¢ąĘąŠ ąŠą║ąĖčüąĮčÄčöčéčīčüčÅ ą┤ąŠ Fe2+:
Fe + H2SO4 (čĆąŠąĘą▒.) = FeSO4 + H2
ąÆ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąĖčģ čĆąŠąĘčćąĖąĮą░čģ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĘą░ą╗č¢ąĘąŠ ąŠą║ąĖčüą╗čÄčöčéčīčüčÅ ą┤ąŠ Fe3+:
2Fe + 6H2SO4 (ą║ąŠąĮčå.) = Fe2(SO4)3 + 3SO2 + 6H2O
ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░, ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čÅ čÅą║ąŠčŚ ą▒ą╗ąĖąĘčīą║ą░ ą┤ąŠ 100%, ą┐ą░čüąĖą▓čāčö ą┐ąŠą▓ąĄčĆčģąĮčÄ ąĘą░ą╗č¢ąĘą░ č¢ čģč¢ą╝č¢čćąĮą░ čĆąĄą░ą║čåč¢čÅ ą┐čĆą░ą║čéąĖčćąĮąŠ ąĮąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ.
ą¤čĆąĖ ą║ąŠąĮčéą░ą║čéč¢ ąĘ ą▒ą░ą│ą░čéčīą╝ą░ ąŠčĆą│ą░ąĮč¢čćąĮąĖą╝ąĖ čĆąĄč湊ą▓ąĖąĮą░ą╝ąĖ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮą░ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ą▓ąĖą┤ą░ą╗čÅčö ąĘ ąĮąĖčģ ąØ2ą×, č鹊ą╝čā čŚčŚ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī čÅą║ ą▓ąŠą┤ąŠą┐ąŠą│ą╗ąĖąĮą░čÄčćąĖą╣ ąĘą░čüč¢ą▒ ą┐čĆąĖ čĆąĄą░ą║čåč¢čÅčģ ąĄč鹥čĆąĖčäč¢ą║ą░čåč¢čŚ, ąĮč¢čéčĆčāą▓ą░ąĮąĮčÅ, čāčéą▓ąŠčĆąĄąĮąĮčÅ ąĄč鹥čĆč¢ą▓ č¢ čé.ą┐. ąÆčāą│ą╗ąĄą▓ąŠą┤ąĖ, čéą░ą║č¢ čÅą║, čüą░čģą░čĆąŠąĘą░ čéą░ ą║čĆąŠčģą╝ą░ą╗čī, ą░ čéą░ą║ąŠąČ ą┐ą░ą┐č¢čĆ č¢ ą┤ąĄčÅą║č¢ č鹥ą║čüčéąĖą╗čīąĮč¢ ą▓ąŠą╗ąŠą║ąĮą░ ąŠą▒ą▓čāą│ą╗čÄčÄčéčīčüčÅ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąŠčÄ čüčāą╗čīčäą░čéąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ. ąŚ ą▓čāą│ą╗ąĄą▓ąŠą┤ąĮčÅą╝ąĖ (ąŠčüąŠą▒ą╗ąĖą▓ąŠ ą░čĆąŠą╝ą░čéąĖčćąĮąĖą╝ąĖ) č¢ č乥ąĮąŠą╗ą░ą╝ąĖ ą┐čĆąŠčéč¢ą║ą░čÄčéčī čĆąĄą░ą║čåč¢čŚ čüčāą╗čīčäčāą▓ą░ąĮąĮčÅ, ą▓ čĆąĄąĘčāą╗čīčéą░čéč¢ čÅą║ąĖčģ čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ čüčāą╗čīč乊ąĮąŠą▓č¢ ą║ąĖčüą╗ąŠčéąĖ, čēąŠ ą╝č¢čüčéčÅčéčī čüčāą╗čīč乊ą│čĆčāą┐ąĖ -SO2OH. ąŚč¢ čüą┐ąĖčĆčéą░ą╝ąĖ čüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ čāčéą▓ąŠčĆčÄčö ąĄčüč鹥čĆąĖ, čēąŠ ą╝č¢čüčéčÅčéčī čüčāą╗čīčäą░čéąĮč¢ ą│čĆčāą┐ąĖ -O-SO2OH.
ąÆąĖčÅą▓ą╗ąĄąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ.
- ąÜąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮčā čüčāą╗čīčäą░čéąĮčā ą║ąĖčüą╗ąŠčéčā ąĘčĆčāčćąĮąŠ č¢ą┤ąĄąĮčéąĖčäč¢ą║čāą▓ą░čéąĖ ą┐ąŠ ąŠą▒ą▓čāą│ą╗ąĄąĮąĮčÄ ąĘą░ąĮčāčĆąĄąĮąŠčŚ ą▓ ąĮąĄčŚ čüą║č¢ą┐ąĖ.
- ąĪčāą╗čīčäą░čé-č¢ąŠąĮąĖ SO42- čāčéą▓ąŠčĆčÄčÄčéčī ąĘ č¢ąŠąĮą░ą╝ąĖ Ba2+ ą▒č¢ą╗ąĖą╣ ą┤čĆč¢ą▒ąĮąŠą║čĆąĖčüčéą░ą╗č¢čćąĮąĖą╣ ąŠčüą░ą┤ čüčāą╗čīčäą░čéčā ą▒ą░čĆč¢čÄ BaSO4.
ąŚą░čüč鹊čüčāą▓ą░ąĮąĮčÅ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ ą▓č¢ą┤ąĮąŠčüąĖčéčīčüčÅ ą┤ąŠ ą┐čĆąŠą┤čāą║čéč¢ą▓ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ čģč¢ą╝č¢čćąĮąŠą│ąŠ ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓ą░. ąćčŚ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī čā ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓č¢ čģč¢ą╝č¢čćąĮąĖčģ ą▓ąŠą╗ąŠą║ąŠąĮ (ą▓č¢čüą║ąŠąĘąĮąŠą│ąŠ čłąŠą▓ą║čā, čłčéčāčćąĮąŠčŚ ą▓ąŠą▓ąĮąĖ, ą┐ąŠą╗č¢ą░ą╝č¢ą┤ąĮąĖčģ ą▓ąŠą╗ąŠą║ąŠąĮ), ą┤ąŠą▒čĆąĖą▓ (čüčāą┐ąĄčĆč乊čüčäą░čé), ą▓ąĖą▒čāčģąŠą▓ąĖčģ čĆąĄč湊ą▓ąĖąĮ, ą╝ąĖčÄčćąĖčģ, ąĘą╝ąŠčćčāčÄčéčī č¢ ąĄą╝čāą╗čīą│čāčÄčćąĖčģ ąĘą░čüąŠą▒č¢ą▓, ą▒ą░čĆą▓ąĮąĖą║č¢ą▓, ą╗č¢ą║ą░čĆčüčīą║ąĖčģ ą┐čĆąĄą┐ą░čĆą░čéč¢ą▓, ą░ čéą░ą║ąŠąČ čĆč¢ąĘąĮąĖčģ čüčāą╗čīčäą░čéč¢ą▓, ąĄč鹥čĆč¢ą▓ č¢ ąĄčüč鹥čĆč¢ą▓, ą┤ąĄčÅą║ąĖčģ ą║ąĖčüą╗ąŠčé (ą│č¢ą┤čĆąŠą│ąĄąĮ čäč鹊čĆąĖą┤ąĮą░ ą║ąĖčüą╗ąŠčéą░, ą▓ąĖąĮąĮą░ ą║ąĖčüą╗ąŠčéą░ č¢ č¢ąĮ.), ą┤ą╗čÅ čĆą░čäč¢ąĮčāą▓ą░ąĮąĮčÅ ą╝č¢ąĮąĄčĆą░ą╗čīąĮąĖčģ ą╝ą░čüąĄą╗, ą┐čĆąĖ čéčĆą░ą▓ą╗ąĄąĮąĮč¢ ą╝ąĄčéą░ą╗č¢ą▓, čÅą║ ą║ąŠą╝ą┐ąŠąĮąĄąĮčé čĆč¢ąĘąĮąĖčģ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéč¢ą▓ (ą┤ą╗čÅ ą┐čĆąŠčåąĄčüč¢ą▓ čģčĆąŠą╝čāą▓ą░ąĮąĮčÅ, ą░ąĮąŠą┤ąĮąŠą│ąŠ ąŠą║ąĖčüąĮąĄąĮąĮčÅ č¢ č¢ąĮ.), čÅą║ ąĄą╗ąĄą║čéčĆąŠą╗č¢čé čüą▓ąĖąĮčåąĄą▓ąĖčģ ą░ą║čāą╝čāą╗čÅč鹊čĆč¢ą▓ č¢ ą┤ą╗čÅ ą▒ą░ą│ą░čéčīąŠčģ č¢ąĮčłąĖčģ čåč¢ą╗ąĄą╣.
ą×ą╗ąĄčāą╝
ąĪčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░, čēąŠ ą╝č¢čüčéąĖčéčī ąĮą░ą┤ą╗ąĖčłąŠą║ čüčāą╗čīčäčāčĆ čéčĆąĖąŠą║čüąĖą┤čā, ąĘąŠą║čĆąĄą╝ą░, čā č乊čĆą╝č¢ ą┤ąĖčüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ H2S2O7. ąóą░ą║ą░ čĆč¢ą┤ą║ą░ čüčāą╝č¢čł H2SO4, H2S2O7 č¢ ąĮą░ą┤ą╗ąĖčłą║ąŠą▓ąŠą│ąŠ SO3 ąĮą░ąĘąĖą▓ą░čöčéčīčüčÅ – ąŠą╗ąĄčāą╝. ą×ą╗ąĄčāą╝ ą┤ąĖą╝ąĖčéčī ąĮą░ ą┐ąŠą▓č¢čéčĆč¢. ąĪą║ą╗ą░ą┤ ąŠą╗ąĄčāą╝čā ą▓ą║ą░ąĘčāčöčéčīčüčÅ ą┐čĆąŠčåąĄąĮčéąĮąĖą╝ ą▓ą╝č¢čüč鹊ą╝ SO3 (ą┐ąŠąĮą░ą┤ ą╝ąŠąĮąŠą│č¢ą┤čĆą░čéčā SO3*H2O, č鹊ą▒č鹊 ą┐ąŠąĮą░ą┤ 100% H2SO4).
ąĪčāą╗čīčäą░čéąĖ
ąĪčāą╗čīčäą░čéąĖ – čüąŠą╗č¢ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ.
ąĪčāą╗čīčäą░čéąĖ ą┐ą╗čÄą╝ą▒čāą╝čā(II), ą║ą░ą╗čīčåč¢čÄ, čüčéčĆąŠąĮčåč¢čÄ č¢ ą▒ą░čĆč¢čÄ ą╝ą░ą╗ąŠ čĆąŠąĘčćąĖąĮąĮč¢ čā ą▓ąŠą┤č¢; ą▒č¢ą╗čīčłč¢čüčéčī č¢ąĮčłąĖčģ čüčāą╗čīčäą░čéč¢ą▓ ą╗ąĄą│ą║ąŠ čĆąŠąĘčćąĖąĮčÅčÄčéčīčüčÅ čā ą▓ąŠą┤č¢. ąĪą┐ąŠčüč¢ą▒ ą▓ąĖčÅą▓ą╗ąĄąĮąĮčÅ čüčāą╗čīčäą░čéč¢ą▓ ą░ąĮą░ą╗ąŠą│č¢čćąĮąĖą╣ čüą┐ąŠčüąŠą▒čā ą▓ąĖčÅą▓ą╗ąĄąĮąĮčÅ č¢ąŠąĮč¢ą▓ SO42- čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ (čĆąĄą░ą║čåč¢čÅ ąĘ Ba2+). ąæą░ą│ą░č鹊 čüčāą╗čīčäą░čéč¢ą▓ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ ąĘąĄą╝ąĮč¢ą╣ ą║ąŠčĆč¢ čā ą▓ąĖą│ą╗čÅą┤č¢ ą╝č¢ąĮąĄčĆą░ą╗č¢ą▓.
ą¤čĆąĖčĆąŠą┤ąĮč¢ čüčāą╗čīčäą░čéąĖ: ą╝č¢čĆą░ą▒č¢ą╗č¢čé (ą│ą╗ą░čāą▒ąĄčĆąŠą▓ą░ čüč¢ą╗čī) Na2SO4*10H2O; ąĄą┐čüąŠą╝č¢čé (ą│č¢čĆą║ą░, ą░ą▒ąŠ ą░ąĮą│ą╗č¢ą╣čüčīą║ą░ čüč¢ą╗čī) MgSO4*7H2O.
ąÜčāą┐ąŠčĆąŠčüąĖ – čåąĄ ą║čĆąĖčüčéą░ą╗ąŠą│č¢ą┤čĆą░čéąĖ čüčāą╗čīčäą░čéč¢ą▓ ą┤ąĄčÅą║ąĖčģ ą┤ą▓ąŠą▓ą░ą╗ąĄąĮčéąĮąĖčģ ą╝ąĄčéą░ą╗č¢ą▓: ąĘą░ą╗č¢ąĘąĮąĖą╣ ą║čāą┐ąŠčĆąŠčü (čüą▓č¢čéą╗ąŠ-ąĘąĄą╗ąĄąĮąĖą╣) FeSO4*7H2O; ą╝č¢ą┤ąĮąĖą╣ ą║čāą┐ąŠčĆąŠčü (ą▒ą╗ą░ą║ąĖčéąĮąĖą╣) CuSO4*5H2O; ąĮč¢ą║ąĄą╗ąĄą▓ąĖą╣ ą║čāą┐ąŠčĆąŠčü (ąĘąĄą╗ąĄąĮąĖą╣) NiSO4*7H2O; ą║ąŠą▒ą░ą╗čīč鹊ą▓ąĖą╣ ą║čāą┐ąŠčĆąŠčü (č鹥ą╝ąĮąŠ-č湥čĆą▓ąŠąĮąĖą╣) CoSO4*7H2O; čåąĖąĮą║ąŠą▓ąĖą╣ ą║čāą┐ąŠčĆąŠčü (ą▒č¢ą╗ąĖą╣) ZnSO4*7H2O
ąōą░ą╗čāąĮ – čåąĄ ą║čĆąĖčüčéą░ą╗ąŠą│č¢ą┤čĆą░čéąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ čüčāą╗čīčäą░čéč¢ą▓, ąĘą░ą│ą░ą╗čīąĮą░ č乊čĆą╝čāą╗ą░ MeI2SO4*MeIII2(SO4)3*24H2O, ą┤ąĄ MeI – K+, NH4+, Rb+, Cs+; MeIII – Cr3+, Al3+, Fe3+, V3+.
ąóčĆąĖą▓č¢ą░ą╗čīąĮč¢ ąĮą░ąĘą▓ąĖ ą┤ąĄčÅą║ąĖčģ ą│ą░ą╗čāąĮč¢ą▓: ą░ą╗čÄą╝ąŠą║ą░ą╗č¢čöą▓ąĖą╣ ą│ą░ą╗čāąĮ K2SO4*Al2(SO4)3*24H2O; čģčĆąŠą╝ąŠą║ą░ą╗č¢čöą▓ąĖą╣ ą│ą░ą╗čāąĮ K2SO4*Cr2(SO4)3*24H2O; ąĘą░ą╗č¢ąĘąŠą║ą░ą╗č¢čöą▓ąĖą╣ ą│ą░ą╗čāąĮ K2SO4*Fe2(SO4)3*24H2O.
ą¦ą░čüč鹊 čüą╗ąŠą▓ąŠ “ą║ą░ą╗č¢čöą▓č¢” ąŠą┐čāčüą║ą░čÄčéčī č¢ ą║ą░ąČčāčéčī čģčĆąŠą╝ąŠą▓ąĖą╣, ąĘą░ą╗č¢ąĘąĮąĖą╣ č¢ čé.ą┤. ą│ą░ą╗čāąĮ, ą░ ą░ą╗čÄą╝ąŠą║ą░ą╗č¢čöą▓ąĖą╣ ą│ą░ą╗čāąĮ ąĮą░ąĘąĖą▓ą░čÄčéčī ą┐čĆąŠčüč鹊 ą│ą░ą╗čāąĮ.
ąĪč¢ą╗čī ą£ąŠčĆą░ – čåąĄ ąĮąĄ ą│ą░ą╗čāąĮ, čģč¢ą╝č¢čćąĮą░ č乊čĆą╝čāą╗ą░ ąĪąŠą╗č¢ ą£ąŠčĆą░ (NH4)2SO4*FeSO4*6H2O. ąÜčĆąĖčüčéą░ą╗ąĖ ąĪąŠą╗č¢ ą£ąŠčĆą░ ą╝ą░čÄčéčī ą║č¢ą╗čīą║č¢čüąĮąŠ č鹊čćąĮąĖą╣ čģč¢ą╝č¢čćąĮąĖą╣ čüą║ą╗ą░ą┤, čÅą║ąĖą╣ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö čģč¢ą╝č¢čćąĮč¢ą╣ č乊čĆą╝čāą╗č¢, ąĪč¢ą╗čī ą£ąŠčĆą░ ą┤ąŠčüčéą░čéąĮčīąŠ čüčéč¢ą╣ą║ą░ ą┤ąŠ ąŠą║ąĖčüąĮąĄąĮąĮčÅ ą║ąĖčüąĮąĄą╝ ą┐ąŠą▓č¢čéčĆčÅ, ą║čĆč¢ą╝ čåčīąŠą│ąŠ, ą╝ą░čüąŠą▓ą░ čćą░čüčéą║ą░ Fe2+ ą▓ ąĪąŠą╗č¢ ą£ąŠčĆą░ ą╝ą░čö ąĮąĖąĘčīą║ąĄ ąĘąĮą░č湥ąĮąĮčÅ:
Žē(Fe2+/(NH4)2SO4*FeSO4*6H2O) = Ar(Fe2+) / Mr((NH4)2SO4*FeSO4*6H2O) = 55,8470 / 392,1430 = 0,1424
č鹊ą╝čā ąĪč¢ą╗čī ą£ąŠčĆą░ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą▓ ą░ąĮą░ą╗č¢čéąĖčćąĮč¢ą╣ čģč¢ą╝č¢čŚ ą┤ą╗čÅ ą┐čĆąĖą│ąŠčéčāą▓ą░ąĮąĮčÅ čĆąŠąĘčćąĖąĮč¢ą▓ ąĘ č鹊čćąĮąŠ ą▓č¢ą┤ąŠą╝ąŠčÄ ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čöčÄ č¢ąŠąĮč¢ą▓ Fe2+.
ą¤čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ ą│č¢ą┤čĆąŠčüčāą╗čīčäą░čéč¢ą▓ čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ą┤ąĖčüčāą╗čīčäą░čéčéąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤:
2NaHSO4 = Na2S2O7 + H2O
ąöąĖčüčāą╗čīčäą░čéąĖ – čåąĄ čüąŠą╗č¢ ą┤ąĖčüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ H2S2O7.
ąĪą┐ąŠą╗čāą║ąĖ čüčāą╗čīčäčāčĆčā
ąóč¢ąŠčüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ H2S2O3 čüčéč¢ą╣ą║ą░ čéč¢ą╗čīą║ąĖ ą┐čĆąĖ ąĮąĖąĘčīą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ (ąĮąĖąČč湥 -72*ąĪ). ąĪąŠą╗č¢ čéč¢ąŠčüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ – čéč¢ąŠčüčāą╗čīčäą░čéąĖ – čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ą┐čĆąĖ ą║ąĖą┐’čÅčéč¢ąĮąĮč¢ čĆąŠąĘčćąĖąĮč¢ą▓ čüčāą╗čīčäč¢čéč¢ą▓ ą╝ąĄčéą░ą╗č¢ą▓ ąĘ ąĮą░ą┤ą╗ąĖčłą║ąŠą╝ čüč¢čĆą║ąĖ:
Na2SO3 + S = Na2S2O3
ą×čéčĆąĖą╝ą░čéąĖ ą║ąĖčüą╗ąŠčéčā H2S2O3 ą▓ąĖčéč¢čüąĮąĄąĮąĮčÅą╝ čŚčŚ ąĘ čéč¢ąŠčüčāą╗čīčäą░čéč¢ą▓ ąĘą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ čüąĖą╗čīąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ ąĮąĄ ą▓ą┤ą░čöčéčīčüčÅ, ąŠčüą║č¢ą╗čīą║ąĖ ą▓ąŠąĮą░ čĆąŠąĘą║ą╗ą░ą┤ą░čöčéčīčüčÅ:
Na2S2O3 + 2HCl = 2NaCl + SO2 + S + H2O
ą¤ąĄčĆąŠą║čüąŠą┤ąĖčüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ H2S2O8, ą░ą▒ąŠ H2S2O6(O2) – ą▒č¢ą╗čīčł č鹊čćąĮąĖą╣ ąĘą░ą┐ąĖčü č乊čĆą╝čāą╗ąĖ, ą╝č¢čüčéąĖčéčī ą┐ąĄčĆąŠą║čüąŠą│čĆčāą┐ą┐čā -O-O-, čā ą▓č¢ą╗čīąĮąŠą╝čā ą▓ąĖą│ą╗čÅą┤č¢ ą┤čāąČąĄ ąĮąĄčüčéč¢ą╣ą║ą░. CąŠą╗č¢ ą┐ąĄčĆąŠą║čüąŠą┤ąĖčüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ – ą┐ąĄčĆąŠą║čüąŠą┤ąĖčüčāą╗čīčäą░čéąĖ – ą┤čāąČąĄ čüąĖą╗čīąĮč¢ ąŠą║ąĖčüąĮčÄą▓ą░čćč¢, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą║ą░ą╗č¢ą╣ ą┐ąĄčĆąŠą║čüąŠą┤ąĖčüčāą╗čīčäą░čé K2S2O8.
ąÆč¢ą┤ąŠą╝ą░ ą┐ąĄčĆąŠą║čüąŠą╝ąŠąĮąŠčüčāą╗čīčäą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░ (ą║ąĖčüą╗ąŠčéą░ ąÜą░čĆąŠ) H2SO3(O2).
ąöąĖčéč¢ąŠąĮč¢čüčéą░ ą║ąĖčüą╗ąŠčéą░ H2S2O4 čā ą▓č¢ą╗čīąĮąŠą╝čā ą▓ąĖą│ą╗čÅą┤č¢ ąĮąĄ ą▓č¢ą┤ąŠą╝ą░, ą░ą╗ąĄ ąŠčéčĆąĖą╝ą░ąĮą░ čŚčŚ čüč¢ą╗čī ąĮą░čéčĆč¢ą╣ ą┤ąĖčéč¢ąŠąĮč¢čé Na2S2O4, čÅą║ą░ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą▓ čÅą║ąŠčüčéč¢ ą▓č¢ą┤ąĮąŠą▓ąĮąĖą║ą░, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą┐čĆąĖ čüąĖąĮč鹥ąĘč¢ ą║čāą▒ąŠą▓ąĖčģ ą▒ą░čĆą▓ąĮąĖą║č¢ą▓, ą┐čĆąĖ ą▓ąĖčéčĆą░ą▓ąĮąŠą╝ ą┤čĆčāą║čāą▓ą░ąĮąĮč¢ č¢ ą▓ ą┐čĆąŠčåąĄčüą░čģ ą▓č¢ą┤ą▒č¢ą╗čÄą▓ą░ąĮąĮčÅ. ąØą░čéčĆč¢ą╣ ą┤ąĖčéč¢ąŠąĮč¢čé ąŠčéčĆąĖą╝čāčÄčéčī ą┐čĆąŠą┤čāą▓ą░ąĮąĮčÅą╝ čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤čā ą▓ ą▓ąŠą┤ąĮčā čüčāčüą┐ąĄąĮąĘč¢čÄ čåąĖąĮą║čā:
Zn + 2SO2 = Zn2+ + S2O42-
c ą┐ąŠą┤ą░ą╗čīčłąĖą╝ ą▓ąĖą┤ą░ą╗ąĄąĮąĮčÅą╝ ąĘ čĆąŠąĘčćąĖąĮčā č¢ąŠąĮč¢ą▓ Zn2+ ą┤ąŠą┤ą░ą▓ą░ąĮąĮčÅą╝ ąĮą░čéčĆč¢ą╣ ą║ą░čĆą▒ąŠąĮą░čéčā č¢ ą║čĆąĖčüčéą░ą╗č¢ąĘą░čåč¢čöčÄ Na2S2O4. ąåąŠąĮ S2O42- ą╝č¢čüčéąĖčéčī ą▒ąĄąĘą┐ąŠčüąĄčĆąĄą┤ąĮč¢ą╣ čģč¢ą╝č¢čćąĮąĖą╣ ąĘą▓’čÅąĘąŠą║ -S-S-.
ąöąĖčéč¢ąŠąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2S2O6, čŚčŚ čüąŠą╗č¢ ą┤ąĖčéč¢ąŠąĮą░čéąĖ, č¢ č鹥čéčĆą░čéč¢ąŠąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2S4O6, čŚčŚ čüąŠą╗č¢ č鹥čéčĆą░čéč¢ąŠąĮą░čéąĖ, č¢čüąĮčāčÄčéčī čéč¢ą╗čīą║ąĖ ą▓ čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮąŠą╝čā ą▓ąŠą┤ąĮąŠą╝čā čĆąŠąĘčćąĖąĮč¢. ąÆąŠąĮąĖ ą╝č¢čüčéčÅčéčī ą┐ąŠą▓’čÅąĘą░ąĮč¢ ą▒ąĄąĘą┐ąŠčüąĄčĆąĄą┤ąĮčīąŠ ą▓ ą╗ą░ąĮčåčĹȹŠą║ ą┤ą▓ą░ č¢ č湊čéąĖčĆąĖ ą░č鹊ą╝ą░ čüčāą╗čīčäčāčĆčā (-S-S- č¢ -S-S-S-S-).
ą£ą░ąĮą│ą░ąĮ(II) ą┤ąĖčéč¢ąŠąĮą░čé MnS2O6 čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐čĆąĖ ąŠą▒čĆąŠą▒čåč¢ ą╝ą░ąĮą│ą░ąĮ ą┤č¢ąŠą║čüąĖą┤čā (ą┐č¢čĆąŠą╗čĹʹĖčé), čüčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤ąŠą╝:
MnO2 + 2SO2 = MnS2O6
ąØą░čéčĆč¢ą╣ č鹥čéčĆą░čéč¢ąŠąĮą░čé Na2S4O6 čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐čĆąĖ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ ąĮą░čéčĆč¢ą╣ čéč¢ąŠčüčāą╗čīčäą░čéčā ąĘ ą╣ąŠą┤ąŠą╝:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
ąåąĮčłč¢ ąŠą║čüąĖą│ąĄąĮą▓ą╝č¢čüąĮč¢ ą║ąĖčüą╗ąŠčéąĖ čüčāą╗čīčäčāčĆčā – čåąĄ čüčāą╗čīč乊ą║čüč¢ą╗ąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2SO2, čéč¢ąŠčüčāą╗čīčäč¢čéąĮą░ ą║ąĖčüą╗ąŠčéą░ H2S2O2, čéčĆąĖčéč¢ąŠąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2S3O6 (čéčĆąĖčéč¢ąŠąĮą░čéąĖ), ą┐ąĄąĮčéą░čéč¢ąŠąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2S5O6 (ą┐ąĄąĮčéą░čéč¢ąŠąĮą░čéąĖ), ą│ąĄą║čüą░čéč¢ąŠąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ H2S6O6 (ą│ąĄą║čüą░čéč¢ąŠąĮą░čéąĖ).
ąöąĖčüčāą╗čīčäčāčĆ ą┤ąĖčģą╗ąŠčĆąĖą┤ Cl2S2 – ą┐ąŠą╝ą░čĆą░ąĮč湥ą▓ąŠ-ąČąŠą▓čéą░, č¢ąĮąŠą┤č¢ ą▒ąĄąĘą▒ą░čĆą▓ąĮą░ čĆč¢ą┤ąĖąĮą░, čÅą║ą░ ą┤ąĖą╝ąĖčéčī čā ą▓ąŠą╗ąŠą│ąŠą╝čā ą┐ąŠą▓č¢čéčĆč¢ ąĘ čģą░čĆą░ą║č鹥čĆąĮąĖą╝ ąĘą░ą┤čāčłą╗ąĖą▓ąĖą╝ ąĘą░ą┐ą░čģąŠą╝. ąŻčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ čüč¢čĆą║ąĖ ąĘ ąĮąĄčüčéą░č湥čÄ čģą╗ąŠčĆčā. ąŚą░čüč鹊čüąŠą▓čāčÄčéčī ą┐čĆąĖ ą▓čāą╗ą║ą░ąĮč¢ąĘą░čåč¢čŚ ą║ą░čāčćčāą║čā.
ąĪčāą╗čīčäčāčĆ ą│ąĄą║čüą░čäą╗čāąŠčĆąĖą┤ SF6 – ą▒ąĄąĘą▒ą░čĆą▓ąĮąĖą╣ ą│ą░ąĘ ą▒ąĄąĘ ąĘą░ą┐ą░čģčā. ąźč¢ą╝č¢čćąĮąŠ č¢ąĮąĄčĆčéąĮąĖą╣. ąÆ č鹥čģąĮč¢čåč¢ ąĘą░čüč鹊čüąŠą▓čāčÄčéčī čÅą║ ą│ą░ąĘąŠą▓ąĖą╣ ąĄą╗ąĄą║čéčĆąĖčćąĮąĖą╣ č¢ąĘąŠą╗čÅč鹊čĆ.
ąĪčāą╗čīčäčāčĆ ą┤č¢ąŠą║čüąĖą┤-ą┤č¢čģą╗ąŠčĆąĖą┤ (čüčāą╗čīčäčāčĆč¢ą╗čģą╗ąŠčĆąĖą┤) SCl2O2 č¢ čüčāą╗čīčäčāčĆ ąŠą║čüąĖą┤-ą┤č¢čģą╗ąŠčĆąĖą┤ (čéč¢ąŠąĮč¢ą╗čģą╗ąŠčĆąĖą┤) SCl2O – ą▒ąĄąĘą▒ą░čĆą▓ąĮč¢ čĆč¢ą┤ąĖąĮąĖ, čēąŠ čāčéą▓ąŠčĆčÄčÄčéčī ąĮą░ ą┐ąŠą▓č¢čéčĆč¢ čéčāą╝ą░ąĮ č¢ ą▓ąĖą║ą╗ąĖą║ą░čÄčéčī čüąĖą╗čīąĮąĖą╣ ą║ą░čłąĄą╗čī. ą¤ąŠą▓ąĮč¢čüčéčÄ ą│č¢ą┤čĆąŠą╗č¢ąĘčāčÄčéčīčüčÅ ą▓ąŠą┤ąŠčÄ:
SCl2O2 + 2H2O = H2SO4 + 2HCl
SCl2O + H2O = SO2 + 2HCl
ąÆč¢ą┤ąŠą╝ą░ čéą░ą║ąŠąČ čģą╗ąŠčĆčüčāą╗čīč乊ąĮąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░ HSO3Cl, ą░ą▒ąŠ SO2(OH)Cl.










