ąźą╗ąŠčĆ Cl ą▓ą┐ąĄčĆą▓čŗąĄ ą▓ čüą▓ąŠą▒ąŠą┤ąĮąŠą╝ ą▓ąĖą┤ąĄ ą▓čŗą┤ąĄą╗ąĄąĮ ą▓ 1774 ą│ąŠą┤čā (ą©ąĄąĄą╗ąĄ, ą©ą▓ąĄčåąĖčÅ). ąĀą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĖąĄ čģą╗ąŠčĆą░ ą▓ ą┐čĆąĖčĆąŠą┤ąĄ. ąźą╗ąŠčĆ – ąŠą┤ąĖąĮąĮą░ą┤čåą░čéčŗą╣ 菹╗ąĄą╝ąĄąĮčé ą┐ąŠ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮąŠčüčéąĖ ąĮą░ ąŚąĄą╝ą╗ąĄ. ąÆčüčéčĆąĄčćą░ąĄčéčüčÅ č鹊ą╗čīą║ąŠ ą▓ čüą▓čÅąĘą░ąĮąĮąŠą╝ ą▓ąĖą┤ąĄ. ąÆčģąŠą┤ąĖčé ą▓ čüąŠčüčéą░ą▓ ą╝ąĮąŠą│ąĖčģ ą╝ąĖąĮąĄčĆą░ą╗ąŠą▓, čüąŠą┤ąĄčƹȹĖčéčüčÅ ą▓ ą▓ąĖą┤ąĄ ąĖąŠąĮąŠą▓ Cl– ą▓ ą╝ąŠčĆčüą║ąŠą╣ ą▓ąŠą┤ąĄ, ąĖąĘ ą║ąŠč鹊čĆąŠą╣ čģą╗ąŠčĆ ą┐ąĄčĆąĄčģąŠą┤ąĖčé ą▓ čüąŠą╗čÅąĮčŗąĄ ąĘą░ą╗ąĄąČąĖ.
ą£ąĖąĮąĄčĆą░ą╗čŗ čģą╗ąŠčĆą░: ą│ą░ą╗ąĖčé (ą║ą░ą╝ąĄąĮąĮą░čÅ čüąŠą╗čī) NaCl; ą║ą░čĆąĮą░ą╗ą╗ąĖčé KCl*MgCl2*6H2O; čüąĖą╗čīą▓ąĖąĮ KCl; ą║ą░ąĖąĮąĖčé KCl*MgSO4*3H2O.
ążąĖąĘąĖąŠą╗ąŠą│ąĖč湥čüą║ąŠąĄ ą┤ąĄą╣čüčéą▓ąĖąĄ čģą╗ąŠčĆą░. ąźą╗ąŠčĆąĖą┤-ąĖąŠąĮčŗ Cl– ąČąĖąĘąĮąĄąĮąĮąŠ ą▓ą░ąČąĮčŗ ą┤ą╗čÅ ą▓čüąĄčģ ąČąĖą▓čŗčģ ąŠčĆą│ą░ąĮąĖąĘą╝ąŠą▓. ą×ąĮąĖ čāčćą░čüčéą▓čāčÄčé ą▓ ą▓čŗčĆą░ą▒ąŠčéą║ąĄ ąČąĄą╗čāą┤ąŠčćąĮąŠą│ąŠ čüąŠą║ą░ ąĖ čĆąĄą│čāą╗ąĖčĆąŠą▓ą░ąĮąĖąĖ ą▓ąŠą┤ąĮąŠą│ąŠ ąŠą▒ą╝ąĄąĮą░.
ą¤ąŠą╗čāč湥ąĮąĖąĄ čģą╗ąŠčĆą░.
- ą×čüąĮąŠą▓ąĮąŠą╣ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮčŗą╣ čüą┐ąŠčüąŠą▒ – 菹╗ąĄą║čéčĆąŠą╗ąĖąĘ čģą╗ąŠčĆąĖą┤ąŠą▓ čēąĄą╗ąŠčćąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖą╗ąĖ čģą▓ąŠčüč鹊ą▓čŗčģ ąŠčéčģąŠą┤ąŠą▓ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ, ą┐ąŠą╗čāčćą░ąĄą╝čŗčģ ą┐čĆąĖ čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĖ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣.
- ą×ą║ąĖčüą╗ąĄąĮąĖąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ąŠąĘą┤čāčģąŠą╝ ą▓ ą┐čĆąĖčüčāčéčüčéą▓ąĖąĖ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆąŠą▓ CuCl2, FeCl3 (ą┐čĆąŠčåąĄčüčü ąöąĖą║ąŠąĮą░):
4HCl + O2 = 2H2O + 2Cl2
ąĪą┐ąŠčüąŠą▒ čéą░ą║ąČąĄ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ.
- ą×ą║ąĖčüą╗ąĄąĮąĖąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ ą┐ąĄčĆą╝ą░ąĮą│ą░ąĮą░č鹊ą╝ ą║ą░ą╗ąĖčÅ, ąŠą║čüąĖą┤ąŠą╝ ą╝ą░čĆą│ą░ąĮčåą░(IV), ą│ąĖą┐ąŠčģą╗ąŠčĆąĖč鹊ą╝ ą║ą░ą╗čīčåąĖčÅ ąĖ ą┤čĆ., ąĮą░ą┐čĆąĖą╝ąĄčĆ:
2KMnO4 + 16HCl (ą║ąŠąĮčå.) = 2KCl + 2MnCl2 + 8H2O + 5Cl2
MnO2 + 4HCl (ą║ąŠąĮčå.) = MnCl2 + 2H2O + Cl2
Ca(ClO)2 + 4HCl (ą║ąŠąĮčå.) = CaCl2 + 2H2O + 2Cl2
ąŁčéąĖ čüą┐ąŠčüąŠą▒čŗ ą┐čĆąĖą╝ąĄąĮčÅčÄčé ą┤ą╗čÅ ą┐ąŠą╗čāč湥ąĮąĖčÅ čģą╗ąŠčĆą░ ą▓ ą╗ą░ą▒ąŠčĆą░č鹊čĆąĮčŗčģ čāčüą╗ąŠą▓ąĖčÅčģ.
ążąĖąĘąĖąŠą╗ąŠą│ąĖč湥čüą║ąŠąĄ ą┤ąĄą╣čüčéą▓ąĖąĄ čģą╗ąŠčĆą░. ąōą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╣ čģą╗ąŠčĆ čĆą░ąĘą┤čĆą░ąČą░čÄčēąĄ ą┤ąĄą╣čüčéą▓čāąĄčé ąĮą░ čüą╗ąĖąĘąĖčüčéčāčÄ ąŠą▒ąŠą╗ąŠčćą║čā ąŠčĆą│ą░ąĮąŠą▓ ą┤čŗčģą░ąĮąĖčÅ, čĆą░ąĘčĆčāčłą░ąĄčé ą╗ąĄą│ą║ąĖąĄ. ąÆą┤čŗčģą░ąĮąĖąĄ ą▓ č鹥č湥ąĮąĖąĄ 1-2 čćą░čüą░ ą▓ąŠąĘą┤čāčģą░, čüąŠą┤ąĄčƹȹ░čēąĄą│ąŠ 0,05 % Cl2, ą╝ąŠąČąĄčé ą┐čĆąĖą▓ąĄčüčéąĖ ą║ čāą┤čāčłčīčÄ ąĖ čüą╝ąĄčĆčéąĖ. ąźą╗ąŠčĆ – ą┐ąĄčĆą▓ąŠąĄ ą▒ąŠąĄą▓ąŠąĄ ąŠčéčĆą░ą▓ą╗čÅčÄčēąĄąĄ ą▓ąĄčēąĄčüčéą▓ąŠ, ą┐čĆąĖą╝ąĄąĮąĄąĮąĮąŠąĄ ą▓ 1915 ą│ąŠą┤čā ą│ąŠčüčāą┤ą░čĆčüčéą▓ąŠą╝ ąōąĄčĆą╝ą░ąĮąĖąĄą╣ ą▓ ą▒ąŠčÅčģ ą┐ąŠą┤ ą│ąŠčĆąŠą┤ąŠą╝ ąśą┐čĆ (ąæąĄą╗čīą│ąĖčÅ).
ąĪą▓ąŠą╣čüčéą▓ą░ čģą╗ąŠčĆą░. ą¤čĆąŠčüč鹊ąĄ ą▓ąĄčēąĄčüčéą▓ąŠ Cl2 – ąČąĄą╗č鹊-ąĘąĄą╗ąĄąĮčŗą╣, ąĮąĄą│ąŠčĆčÄčćąĖą╣ ą│ą░ąĘ čü čāą┤čāčłą░čÄčēąĖą╝ ąĘą░ą┐ą░čģąŠą╝, ą▓ 2,5 čĆą░ąĘą░ čéčÅąČąĄą╗ąĄąĄ ą▓ąŠąĘą┤čāčģą░. ąŻą╝ąĄčĆąĄąĮąĮąŠ čĆą░čüčéą▓ąŠčĆąĖą╝ ą▓ ą▓ąŠą┤ąĄ (ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ŌĆ£čģą╗ąŠčĆąĮą░čÅ ą▓ąŠą┤ą░ŌĆØ). ąźą╗ąŠčĆ ąŠč湥ąĮčī čĆąĄą░ą║čåąĖąŠąĮąĮąŠčüą┐ąŠčüąŠą▒ąĄąĮ, ą▓čŗč鹥čüąĮčÅąĄčé ą▒čĆąŠą╝ ąĖ ąĖąŠą┤ ąĖąĘ ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čü ą▓ąŠą┤ąŠčĆąŠą┤ąŠą╝ ąĖ ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ; čüąŠ ą╝ąĮąŠą│ąĖą╝ąĖ 菹╗ąĄą╝ąĄąĮčéą░ą╝ąĖ ąŠą▒čĆą░ąĘčāąĄčé čģą╗ąŠčĆąĖą┤čŗ. ą¤ąŠčĆąŠčłą║ąŠąŠą▒čĆą░ąĘąĮčŗąĄ čüčāčĆčīą╝ą░, ą╝čŗčłčīčÅą║ ąĖ čĆą░čüą║ą░ą╗ąĄąĮąĮąŠąĄ ąČąĄą╗ąĄąĘąŠ čüą│ąŠčĆą░čÄčé ą▓ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą╝ čģą╗ąŠčĆąĄ, ąĮą░ą┐čĆąĖą╝ąĄčĆ:
2Fe + 3Cl2 = 2FeCl3
ąĪą┐ą╗ą░ą▓ č鹊ą╝ą┐ą░ą║ ąĘą░ą│ąŠčĆą░ąĄčéčüčÅ ą▓ čģą╗ąŠčĆąĄ, ą░ čćąĖčüč鹊ąĄ ąĘąŠą╗ąŠč鹊 čĆąĄą░ą│ąĖčĆčāąĄčé čü čģą╗ąŠčĆąŠą╝ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ AuCl3.
ąĪą╝ąĄčüąĖ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗčģ čģą╗ąŠčĆą░ ąĖ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ąĘčĆčŗą▓ą░čÄčéčüčÅ ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ąĖą╗ąĖ ąŠčüą▓ąĄčēąĄąĮąĖąĖ:
H2 + Cl2 Ōćä 2HCl
ą¤čĆąĖ ąĮą░čüčŗčēąĄąĮąĖąĖ čģą╗ąŠčĆąŠą╝ čģąŠą╗ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ čēąĄą╗ąŠčćąĖ ą┐ąŠą╗čāčćą░čÄčéčüčÅ čģą╗ąŠčĆąĖą┤čŗ ąĖ ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčéčŗ:
2NaOH + Cl2 = NaCl + NaClO + H2O
ąŻą│ą╗ąĄą▓ąŠą┤ąŠčĆąŠą┤čŗ ą┐čĆąĖ ą┤ąĄą╣čüčéą▓ąĖąĖ Cl2 ąŠą▒čĆą░ąĘčāčÄčé (ą┐ąŠ čĆąĄą░ą║čåąĖčÅą╝ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ ąĖą╗ąĖ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ) čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖąĄ čģą╗ąŠčĆą┐čĆąŠąĖąĘą▓ąŠą┤ąĮčŗąĄ, ąĮą░ą┐čĆąĖą╝ąĄčĆ:
CH4 + Cl2 = CH3Cl + HCl
ąĪą║ąĖą┐ąĖą┤ą░čĆ ąĘą░ą│ąŠčĆą░ąĄčéčüčÅ ą▓ ą░čéą╝ąŠčüč乥čĆąĄ čģą╗ąŠčĆą░. ąÆą╗ą░ąČąĮčŗą╣ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╣ čģą╗ąŠčĆ ąŠą▒ąĄčüčåą▓ąĄčćąĖą▓ą░ąĄčé ą╝ąĮąŠą│ąĖąĄ ą║čĆą░čüąĖč鹥ą╗ąĖ, ąŠčüąŠą▒ąĄąĮąĮąŠ čüąĖą╗čīąĮąŠ ąĮą░ čüąŠą╗ąĮąĄčćąĮąŠą╝ čüą▓ąĄčéčā; čŹč鹊 ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ąĮąĄčāčüč鹊ą╣čćąĖą▓ąŠą╣ čģą╗ąŠčĆąĮąŠą▓ą░čéąĖčüč鹊ą╣ ą║ąĖčüą╗ąŠčéčŗ ąĖ čĆą░ąĘą╗ąŠąČąĄąĮąĖąĄą╝ ąĄąĄ ąĮą░ čüą▓ąĄčéčā ąĮą░ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ ąĖ ą░č鹊ą╝ąĮčŗą╣ ą║ąĖčüą╗ąŠčĆąŠą┤ (čüąĖą╗čīąĮąĄą╣čłąĖą╣ ąŠą║ąĖčüą╗ąĖč鹥ą╗čī):
Cl2 + H2O Ōćä HClO + HCl
HClO ŌåÆ HCl + O
ą¤ąŠčŹč鹊ą╝čā ŌĆ£čģą╗ąŠčĆąĮčāčÄ ą▓ąŠą┤čāŌĆØ čüą╗ąĄą┤čāąĄčé čģčĆą░ąĮąĖčéčī ą▓ č鹥ą╝ąĮčŗčģ čüą║ą╗čÅąĮą║ą░čģ (ą╗čāčćčłąĄ ą▓ č鹥ą╝ąĮąŠč鹥).
ąźąĖą╝ąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░ čģą╗ąŠčĆą░, ąĖ ąĄą│ąŠ ą┐čĆąĖą╝ąĄąĮąĄąĮąĖąĄ ą┐ąŠą║ą░ąĘą░ąĮčŗ ąĮą░ čüčģąĄą╝ąĄ.
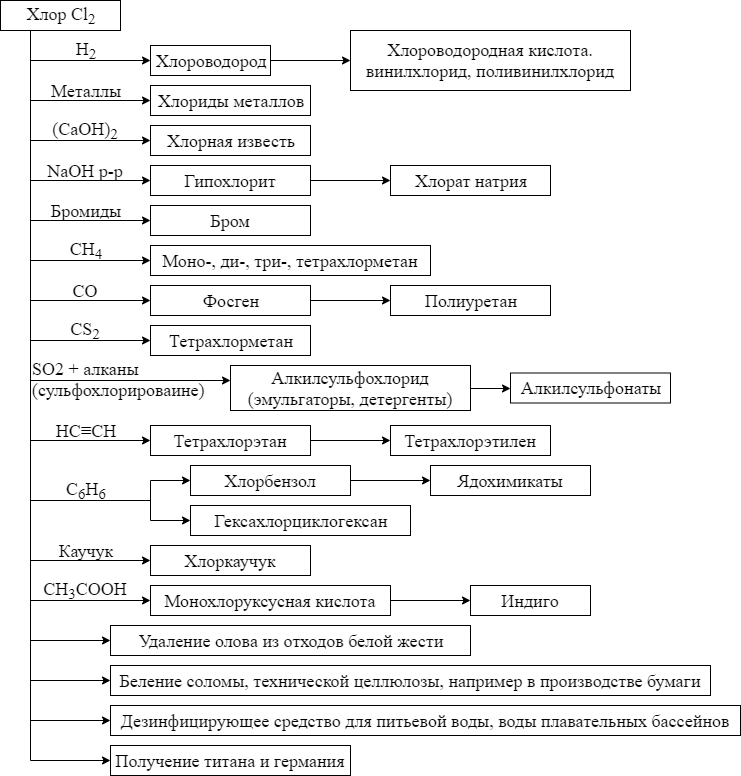
ą¤čĆąĖą╝ąĄąĮąĄąĮąĖąĄ čģą╗ąŠčĆą░. ąźą╗ąŠčĆ ąŠčéąĮąŠčüąĖčéčüčÅ ą║ ą┐čĆąŠą┤čāą║čéą░ą╝ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ą░. ą¢ąĖą┤ą║ąĖą╣ čüčāčģąŠą╣ čģą╗ąŠčĆ ą┐ąĄčĆąĄą▓ąŠąĘčÅčé ą▓ ąČąĄą╗ąĄąĘąĮąŠą┤ąŠčĆąŠąČąĮčŗčģ čåąĖčüč鹥čĆąĮą░čģ ąĖ ą┐ąĄčĆąĄą║ą░čćąĖą▓ą░čÄčé ą┐ąŠ čüčéą░ą╗čīąĮčŗą╝ čéčĆčāą▒ąŠą┐čĆąŠą▓ąŠą┤ą░ą╝; ą▓ ą┐čĆąŠą┤ą░ąČčā čģą╗ąŠčĆ ą┐ąŠčüčéčāą┐ą░ąĄčé ą▓ čüčéą░ą╗čīąĮčŗčģ ą▒ą░ą╗ą╗ąŠąĮą░čģ čü ą▓ąĄąĮčéąĖą╗čÅą╝ąĖ ąĖąĘ ąŠą╗ąŠą▓čÅąĮąĮąŠ-čåąĖąĮą║ąŠą▓ąŠą╣ ą▒čĆąŠąĮąĘčŗ.
ąĪąŠąĄą┤ąĖąĮąĄąĮąĖčÅ čģą╗ąŠčĆą░
ąźą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ HCl
ą¤ąŠą╗čāč湥ąĮąĖąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ HCl.
- ą¤čĆčÅą╝ąŠą╣ čüąĖąĮč鹥ąĘ ą┐čāč鹥ą╝ čüąČąĖą│ą░ąĮąĖčÅ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ čģą╗ąŠčĆąĄ:
H2 + Cl2 Ōćä 2HCl
- ąÆąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĄ čģą╗ąŠčĆąĖą┤ą░ ąĮą░čéčĆąĖčÅ čü ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣ ą┐čĆąĖ čāą╝ąĄčĆąĄąĮąĮąŠą╝ (čĆąĄą░ą║čåąĖčÅ 1) ąĖą╗ąĖ čüąĖą╗čīąĮąŠą╝ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ (čĆąĄą░ą║čåąĖčÅ 2):
NaCl + H2SO4 = NaHSO4 + HCl (1)
2NaCl + H2SO4 = Na2SO4 + 2HCl (2)
- ąźą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĄ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą▒ąĄąĮąĘąŠą╗ą░; ą▓čŗą┤ąĄą╗čÅąĄčéčüčÅ ą║ą░ą║ ą┐ąŠą▒ąŠčćąĮčŗą╣ ą┐čĆąŠą┤čāą║čé:
C6H6 + Cl2 = C6H5Cl + HCl
ąĪą▓ąŠą╣čüčéą▓ą░ čģą╗ąŠčĆą░. ąæąĄčüčåą▓ąĄčéąĮčŗą╣ ą│ą░ąĘ čü čüąĖą╗čīąĮčŗą╝ ąĘą░ą┐ą░čģąŠą╝. ąōąĖą│čĆąŠčüą║ąŠą┐ąĖčćąĮčŗą╣, ą▓ąŠ ą▓ą╗ą░ąČąĮąŠą╝ ą▓ąŠąĘą┤čāčģąĄ ąŠą▒čĆą░ąĘčāąĄčé čéčāą╝ą░ąĮ. ąźąŠčĆąŠčłąŠ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ ą▓ąŠą┤ąĄ; ą▓ąŠą┤ąĮčŗąĄ čĆą░čüčéą▓ąŠčĆčŗ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ (ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ – čüąŠą╗čÅąĮą░čÅ ą║ąĖčüą╗ąŠčéą░). ąÆ ą▓ąŠą┤ąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ ą┐ąŠą╗ąĮąŠčüčéčīčÄ čĆą░čüą┐ą░ą┤ą░ąĄčéčüčÅ ąĮą░ ąĖąŠąĮčŗ:
HCl = H+ + Cl–; H+ + H2O = H3O+
ą¤čĆąĖ ą║ąŠąĮčéą░ą║č鹥 čü ą░ą╝ą╝ąĖą░ą║ąŠą╝ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ čģą╗ąŠčĆąĖą┤ ą░ą╝ą╝ąŠąĮąĖčÅ, čéą▓ąĄčĆą┤čŗąĄ čćą░čüčéąĖčåčŗ ą║ąŠč鹊čĆąŠą│ąŠ ą▓ ą▓ąŠąĘą┤čāčģąĄ čüąŠąĘą┤ą░čÄčé ą▒ąĄą╗čŗą╣ ą┤čŗą╝:
NH3 + HCl = NH4Cl
ąĀąĄą░ą│ąĖčĆčāąĄčé čü ą░čåąĄčéąĖą╗ąĄąĮąŠą╝ ą┐ąŠą┤ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą▓ąĖąĮąĖą╗čģą╗ąŠčĆąĖą┤ą░:
HCŌēĪCH + HCl ŌåÆ H2C=CHCl
ąźą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ – ą▒ąĄčüčåą▓ąĄčéąĮą░čÅ ąČąĖą┤ą║ąŠčüčéčī, ą┤čŗą╝ąĖčé ąĮą░ ą▓ąŠąĘą┤čāčģąĄ; ą▓ ą┐čĆąŠą┤ą░ąČčā ą┐ąŠčüčéčāą┐ą░ąĄčé čü čüąŠą┤ąĄčƹȹ░ąĮąĖąĄą╝ 38% HCl (čüąŠą╗čÅąĮą░čÅ ą║ąĖčüą╗ąŠčéą░). ąźą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ čü čüąŠą┤ąĄčƹȹ░ąĮąĖąĄą╝ 0,4-0,5% HCl ą▓čģąŠą┤ąĖčé ą▓ čüąŠčüčéą░ą▓ ąČąĄą╗čāą┤ąŠčćąĮąŠą│ąŠ čüąŠą║ą░. ą×ą║ąĖčüą╗ąĖč鹥ą╗čīąĮčŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ąĮąĄ ąŠą▒ą╗ą░ą┤ą░ąĄčé (ą║ąĖčüą╗ąŠčéą░-ąĮąĄąŠą║ąĖąĄą╗ąĖč鹥ą╗čī), čĆąĄą░ą│ąĖčĆčāąĄčé čü ąĮąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗą╝ąĖ ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ čü ą▓čŗą┤ąĄą╗ąĄąĮąĖąĄą╝ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ ą▓ąŠą┤ąŠčĆąŠą┤ą░:
2Al + 6HCl = 2AlCl3 + 2H2
2Al + 6H3O+ = 2Al3+ + 3H2
ą¤čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ čü čüąĖą╗čīąĮčŗą╝ąĖ ąŠą║ąĖčüą╗ąĖč鹥ą╗čÅą╝ąĖ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╣ čģą╗ąŠčĆ.
ą¤čĆąĖą╝ąĄąĮąĄąĮąĖąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ HCl. ąōą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╣ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ čüą╗čāąČąĖčé čüčŗčĆčīąĄą╝ ą▓ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ąĄ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ, čģą╗ąŠčĆąĖą┤ąŠą▓ ąĖ ą▓ąĖąĮąĖą╗čģą╗ąŠčĆąĖą┤ą░ (ą┤ą░ą╗ąĄąĄ ą┐ąĄčĆąĄą▓ąŠą┤ąĖą╝ąŠą│ąŠ ą▓ ą┐ąŠą╗ąĖą▓ąĖąĮąĖą╗čģą╗ąŠčĆąĖą┤). ąźą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą┐čĆąĖ čéčĆą░ą▓ą╗ąĄąĮąĖąĖ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą▓ ą║ą░č湥čüčéą▓ąĄ ą┐ą░čÅą╗čīąĮąŠą╣ ąČąĖą┤ą║ąŠčüčéąĖ (Zn + HCl) – ą┐ą░čÅą╗čīąĮą░čÅ ą║ąĖčüą╗ąŠčéą░, ą┤ą╗čÅ ąĖąĘą▓ą╗ąĄč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖąĘ čĆčāą┤, ą┤ą╗čÅ ą┐ąŠą╗čāč湥ąĮąĖčÅ čģą╗ąŠčĆąĖą┤ąŠą▓ ąĖ čģą╗ąŠčĆą░.
ąźą╗ąŠčĆąĖą┤čŗ
ąźą╗ąŠčĆąĖą┤čŗ – čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ čŹą╗ąĄą╝ąĄąĮč鹊ą▓ čü čģą╗ąŠčĆąŠą╝. ą£ąĖąĮąĄčĆą░ą╗ąŠą│ąĖč湥čüą║ąĖąĄ ąĖ čéčĆąĖą▓ąĖą░ą╗čīąĮčŗąĄ ąĮą░ąĘą▓ą░ąĮąĖčÅ ąĮąĄą║ąŠč鹊čĆčŗčģ čģą╗ąŠčĆąĖą┤ąŠą▓ ą╝ąĄčéą░ą╗ą╗ąŠą▓: NaCl – ą│ą░ą╗ąĖčé, ą║ą░ą╝ąĄąĮąĮą░čÅ čüąŠą╗čī, ą┐ąŠą▓ą░čĆąĄąĮąĮą░čÅ čüąŠą╗čī; čüąĖą╗čīą▓ąĖąĮ KCl; ąĮą░čłą░čéčŗčĆčī NH4Cl; čüčāą╗ąĄą╝ą░, čüčāą▒ą╗ąĖą╝ą░čé HgCl2; ą║ą░ą╗ąŠą╝ąĄą╗čī Hg2Cl2; čĆąŠąĘąŠą▓ą░čÅ čüąŠą╗čī (NH4)2[SnCl6].
ąæąŠą╗čīčłąĖąĮčüčéą▓ąŠ čģą╗ąŠčĆąĖą┤ąŠą▓ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čģąŠčĆąŠčłąŠ čĆą░čüčéą▓ąŠčĆąĖą╝ąŠ ą▓ ą▓ąŠą┤ąĄ. ąśčüą║ą╗čÄč湥ąĮąĖčÅ čüąŠčüčéą░ą▓ą╗čÅčÄčé: AgCl, Hg2Cl2, TlCl, PbCl2, ą▓ čģąŠą╗ąŠą┤ąĮąŠą╣ ą▓ąŠą┤ąĄ ąŠąĮąĖ ąŠč湥ąĮčī ą╝ą░ą╗ąŠ čĆą░čüčéą▓ąŠčĆąĖą╝čŗ.
ą×ą▒ąĮą░čĆčāąČąĄąĮąĖąĄ čģą╗ąŠčĆąĖą┤ąŠą▓. ąśąĘ čĆą░čüčéą▓ąŠčĆąŠą▓, čüąŠą┤ąĄčƹȹ░čēąĖčģ ąĖąŠąĮčŗ Cl–, ą┐čĆąĖ ą┐ąŠą┤ą║ąĖčüą╗ąĄąĮąĖąĖ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣ ąĖ ą┤ąŠą▒ą░ą▓ą╗ąĄąĮąĖąĖ čĆą░čüčéą▓ąŠčĆą░ AgNO3 ą▓čŗą┐ą░ą┤ą░ąĄčé ą▒ąĄą╗čŗą╣ čģą╗ąŠą┐čīąĄą▓ąĖą┤ąĮčŗą╣ ąŠčüą░ą┤ąŠą║ AgCl, ą┐ąŠčüč鹥ą┐ąĄąĮąĮąŠ č鹥ą╝ąĮąĄčÄčēąĖą╣ ąĮą░ čüą▓ąĄčéčā, ą║ąŠč鹊čĆčŗą╣ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ą░ą╝ą╝ąĖą░ą║ą░.
ąÜąĖčüą╗ąŠčĆąŠą┤čüąŠą┤ąĄčƹȹ░čēąĖąĄ ą║ąĖčüą╗ąŠčéčŗ čģą╗ąŠčĆą░ ąĖ ąĖčģ čüąŠą╗ąĖ
|
ąÜąĖčüą╗ąŠčéą░ |
ąĪąŠą╗čī |
||
|
ążąŠčĆą╝čāą╗ą░ |
ąØą░ąĘą▓ą░ąĮąĖąĄ |
ążąŠčĆą╝čāą╗ą░ |
ąØą░ąĘą▓ą░ąĮąĖąĄ |
|
HClO4 |
ąźą╗ąŠčĆąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ |
MeIClO4 |
ą¤ąĄčĆčģą╗ąŠčĆą░čé |
|
HClO3 |
ąźą╗ąŠčĆąĮąŠą▓ą░čéą░čÅ ą║ąĖčüą╗ąŠčéą░ |
MeIClO3 |
ąźą╗ąŠčĆą░čé |
|
HClO2 |
ąźą╗ąŠčĆąĖčüčéą░čÅ ą║ąĖčüą╗ąŠčéą░ |
MeIClO2 |
ąźą╗ąŠčĆąĖčé |
|
HClO |
ąźą╗ąŠčĆąĮąŠą▓ą░čéąĖčüčéą░čÅ ą║ąĖčüą╗ąŠčéą░ |
MeIClO |
ąōąĖą┐ąŠčģą╗ąŠčĆąĖčé |
ąźą╗ąŠčĆąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ HClO4 – ą╗ąĄą│ą║ąŠą┐ąŠą┤ą▓ąĖąČąĮą░čÅ ą▓ąĘčĆčŗą▓čćą░čéą░čÅ ąČąĖą┤ą║ąŠčüčéčī, ą┐čĆąĖ čāą╝ąĄčĆąĄąĮąĮąŠą╝ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĖąĖ ą┐čĆąĖąĮąĖą╝ą░ąĄčé ą╝ą░čüą╗ąŠąŠą▒čĆą░ąĘąĮčāčÄ ą║ąŠąĮčüąĖčüč鹥ąĮčåąĖčÄ. ąÆąĄčüčīą╝ą░ ąĮąĄčāčüč鹊ą╣čćąĖą▓ą░. ąÆąŠą┤ąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ (72%, ą░ąĘąĄąŠčéčĆąŠą┐ąĮą░čÅ čüą╝ąĄčüčī) ą║ąĖą┐ąĖčé ą┐čĆąĖ 203*ąĪ. ąĪąĖą╗čīąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ. ąśąĘ čĆą░čüčéą▓ąŠčĆąŠą▓ čüąŠą╗ąĄą╣ ą║ą░ą╗ąĖčÅ ąŠčüą░ąČą┤ą░ąĄčé ą▒ąĄą╗čŗą╣ ą┐ąĄčĆčģą╗ąŠčĆą░čé ą║ą░ą╗ąĖčÅ KClO4, ą║ąŠč鹊čĆčŗą╣ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą║ą░ą║ ą░ąĮą░ą╗ąĖčéąĖč湥čüą║ąĖą╣ čĆąĄą░ą║čéąĖą▓.
ąźą╗ąŠčĆąĮąŠą▓ą░čéą░čÅ ą║ąĖčüą╗ąŠčéą░ HClO3 čāčüč鹊ą╣čćąĖą▓ą░ č鹊ą╗čīą║ąŠ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą┐čĆąĖ čüąŠą┤ąĄčƹȹ░ąĮąĖąĖ ąĄąĄ ą┤ąŠ 40%. ąźą╗ąŠčĆą░čéčŗ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą┐čĆąĖ ą┐čĆąŠą┐čāčüą║ą░ąĮąĖąĖ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ čģą╗ąŠčĆą░ č湥čĆąĄąĘ ą│ąŠčĆčÅčćąĖą╣ čĆą░čüčéą▓ąŠčĆ čēąĄą╗ąŠčćąĖ:
6KOH + 3Cl2 = KClO3 + 5KCl + 3H2O
ąĪąŠą╗ąĖ čģą╗ąŠčĆąĮąŠą▓ą░č鹊ą╣ ą║ąĖčüą╗ąŠčéčŗ – čģą╗ąŠčĆą░čéčŗ – čüąĖą╗čīąĮčŗąĄ ąŠą║ąĖčüą╗ąĖč鹥ą╗ąĖ. ąØą░ą┐čĆąĖą╝ąĄčĆ, ą┐čĆąĖ čĆą░čüčéąĖčĆą░ąĮąĖąĖ čüą╝ąĄčüąĖ čģą╗ąŠčĆą░čéą░ ą║ą░ą╗ąĖčÅ čü čüąĄčĆąŠą╣ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą▓ąĘčĆčŗą▓ (ą░ąĮą░ą╗ąŠą│ąĖčćąĮčŗą╣ ąŠą┐čŗčé čü č乊čüč乊čĆąŠą╝ ąŠą┐ą░čüąĄąĮ ą┤ą╗čÅ ąČąĖąĘąĮąĖ!); ą┤čĆąĄą▓ąĄčüąĮą░čÅ ą╗čāčćąĖąĮą░, ą┐ąŠą│čĆčāąČąĄąĮąĮą░čÅ ą▓ čĆą░čüą┐ą╗ą░ą▓ą╗ąĄąĮąĮčŗą╣ čģą╗ąŠčĆą░čé, ąĘą░ą│ąŠčĆą░ąĄčéčüčÅ čü ąĖąĮč鹥ąĮčüąĖą▓ąĮąŠ ą┤čŗą╝čÅčēąĖą╝ ą┐ą╗ą░ą╝ąĄąĮąĄą╝. ą¤čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ čģą╗ąŠčĆą░čéčŗ (ą╗ąĄą│č湥, č湥ą╝ ą┐ąĄčĆčģą╗ąŠčĆą░čéčŗ) ąŠčéą┤ą░čÄčé čüą▓ąŠą╣ ą║ąĖčüą╗ąŠčĆąŠą┤; čĆą░ąĘą╗ąŠąČąĄąĮąĖąĄ ą║ą░čéą░ą╗ąĖčéąĖč湥čüą║ąĖ čāčüą║ąŠčĆčÅąĄčé MnO2 (ą┐ąĖčĆąŠą╗čĹʹĖčé):
2KClO3 = 2KCl + 3O2
ąźą╗ąŠčĆą░čé ą║ą░ą╗ąĖčÅ (ą▒ąĄčĆč鹊ą╗ąĄč鹊ą▓ą░ čüąŠą╗čī) KClO3 ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ąĄ čüą┐ąĖč湥ą║, ą▓ąĘčĆčŗą▓čćą░čéčŗčģ ą▓ąĄčēąĄčüčéą▓ ąĖ ą┐ąĖčĆąŠč鹥čģąĮąĖč湥čüą║ąĖčģ čüčĆąĄą┤čüčéą▓ (ą┐ąĖčüč鹊ąĮčŗ, ąĮąŠą▓ąŠą│ąŠą┤ąĮąĖąĄ čģą╗ąŠą┐čāčłą║ąĖ). ąźą╗ąŠčĆą░čé ąĮą░čéčĆąĖčÅ NaClO3 ą┐čĆąĖą╝ąĄąĮčÅčÄčé ą║ą░ą║ ą│ąĄčĆą▒ąĖčåąĖą┤ąĮąŠąĄ čüčĆąĄą┤čüčéą▓ąŠ ą┤ą╗čÅ ą▒ąŠčĆčīą▒čŗ čü čüąŠčĆąĮčÅą║ą░ą╝ąĖ.
ąźą╗ąŠčĆąĖčüčéą░čÅ ą║ąĖčüą╗ąŠčéą░ HClO2 ąĖąĘą▓ąĄčüčéąĮą░ č鹊ą╗čīą║ąŠ ą▓ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╝ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ, ąŠč湥ąĮčī ąĮąĄčāčüč鹊ą╣čćąĖą▓ą░. ąźą╗ąŠčĆąĖčé ąĮą░čéčĆąĖčÅ NaClO2 ąĖčüą┐ąŠą╗čīąĘčāčÄčé ą║ą░ą║ ąŠčéą▒ąĄą╗ąĖą▓ą░čÄčēąĄąĄ čüčĆąĄą┤čüčéą▓ąŠ.
ąźą╗ąŠčĆąĮąŠą▓ą░čéąĖčüčéą░čÅ ą║ąĖčüą╗ąŠčéą░ HClO čüčāčēąĄčüčéą▓čāąĄčé č鹊ą╗čīą║ąŠ ą▓ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ; čüą░ą╝ą░ ą║ąĖčüą╗ąŠčéą░ ąĖ ąĄąĄ čüąŠą╗ąĖ (ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčéčŗ) – čüąĖą╗čīąĮčŗąĄ ąŠą║ąĖčüą╗ąĖč鹥ą╗ąĖ. ą×ą▒čĆą░ąĘčāąĄčéčüčÅ ą▓ ŌĆ£čģą╗ąŠčĆąĮąŠą╣ ą▓ąŠą┤ąĄŌĆØ. ąōąĖą┐ąŠčģą╗ąŠčĆąĖčé ąĮą░čéčĆąĖčÅ NaClO ąĖ ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčé ą║ą░ą╗ąĖčÅ KClO čÅą▓ą╗čÅčÄčéčüčÅ ą┤ąĄą╣čüčéą▓čāčÄčēąĖą╝ ą▓ąĄčēąĄčüčéą▓ąŠą╝ ą▒ąĄą╗čÅčēąĄą│ąŠ čēąĄą╗ąŠą║ą░ (ą╗ą░ą▒ą░čĆčĆą░ą║ąŠą▓ą░ ą▓ąŠą┤ą░, ąČą░ą▓ąĄą╗ąĄą▓ą░čÅ ą▓ąŠą┤ą░), ąŠą▒čĆą░ąĘčāčÄčēąĄą│ąŠčüčÅ ą┐čĆąĖ ąĮą░čüčŗčēąĄąĮąĖąĖ čĆą░čüčéą▓ąŠčĆąŠą▓ NaOH ąĖ ąÜą×ąØ čģą╗ąŠčĆąŠą╝ ą┐čĆąĖ ą┐ąŠąĮąĖąČąĄąĮąĮąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĄ, ąĮą░ą┐čĆąĖą╝ąĄčĆ:
2KOH + Cl2 = KCl + KClO + H2O
ąæąĄą╗čÅčēąĖą╣ čēčæą╗ąŠą║ ąĖą╝ąĄąĄčé ąĘą░ą┐ą░čģ čģą╗ąŠčĆąĮąŠą▓ą░čéąĖčüč鹊ą╣ ą║ąĖčüą╗ąŠčéčŗ, ą▓čŗą┤ąĄą╗čÅčÄčēąĄą╣čüčÅ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ą│ąĖą┤čĆąŠą╗ąĖąĘą░ ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčéą░ (ąĮąĄą▓ąĄčĆąĮąŠ čāčéą▓ąĄčƹȹ┤ąĄąĮąĖąĄ, čćč鹊 ą▒ąĄą╗čÅčēąĖą╣ čēčæą╗ąŠą║ ą┐ą░čģąĮąĄčé čģą╗ąŠčĆąŠą╝). ą×ąĮ ąŠą▒ą╗ą░ą┤ą░ąĄčé čģąŠčĆąŠčłąĖą╝ąĖ ąŠčéą▒ąĄą╗ąĖą▓ą░čÄčēąĖą╝ąĖ, ą┤ąĄąĘąĖąĮčäąĖčåąĖčĆčāčÄčēąĖą╝ąĖ ąĖ ą┤ąĄąĘą░ą║čéąĖą▓ąĖčĆčāčÄčēąĖą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ; ąĮą░ ąĄą│ąŠ ą┤ąĄąĘą░ą║čéąĖą▓ąĖčĆčāčÄčēąĄą╝ ą┤ąĄą╣čüčéą▓ąĖąĖ ąŠčüąĮąŠą▓ą░ąĮ ą╝ąĄč鹊ą┤ ąŠą▒ąĄąĘą▓čĆąĄąČąĖą▓ą░ąĮąĖčÅ čåąĖą░ąĮąĖą┤-čüąŠą┤ąĄčƹȹ░čēąĖčģ čüč鹊čćąĮčŗčģ ą▓ąŠą┤ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖčģ čåąĄčģąŠą▓. ąźą╗ąŠčĆąĮą░čÅ ąĖąĘą▓ąĄčüčéčī, ą┐ąŠą╗čāčćą░ąĄą╝ą░čÅ ą▓ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ ąĖąĘ čģą╗ąŠčĆą░ ąĖ ą│ą░čłąĄąĮąŠą╣ ąĖąĘą▓ąĄčüčéąĖ Ca(OH)2, ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ čüą╝ąĄčüčī ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčéą░ ą║ą░ą╗čīčåąĖčÅ Ca(ClO)2 čü CaCl2 ąĖ Ca(OH)2. ą¤čĆąĖą╝ąĄąĮčÅčÄčé ą║ą░ą║ ąŠčéą▒ąĄą╗ąĖą▓ą░čÄčēąĄąĄ ąĖ ą┤ąĄąĘąĖąĮčäąĖčåąĖčĆčāčÄčēąĄąĄ čüčĆąĄą┤čüčéą▓ąŠ. ą¦ąĖčüčéčŗą╣ ą│ąĖą┐ąŠčģą╗ąŠčĆąĖčé Ca(ClO)2 ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą┤ą╗čÅ ą┤ąĄąĘą░ą║čéąĖą▓ą░čåąĖąĖ ą▒ąŠąĄą▓čŗčģ ąŠčéčĆą░ą▓ą╗čÅčÄčēąĖčģ ą▓ąĄčēąĄčüčéą▓.
ą×ą║čüąĖą┤čŗ čģą╗ąŠčĆą░
ąōąĄą┐čéą░ąŠą║čüąĖą┤ ą┤ąĖčģą╗ąŠčĆą░ Cl2O7 (ą░ąĮą│ąĖą┤čĆąĖą┤ čģą╗ąŠčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ) – ą▒ąĄčüčåą▓ąĄčéąĮą░čÅ ą╗ąĄčéčāčćą░čÅ ą╝ą░čüą╗ąŠąŠą▒čĆą░ąĘąĮą░čÅ ąČąĖą┤ą║ąŠčüčéčī. ąÆąĘčĆčŗą▓ąŠąŠą┐ą░čüąĄąĮ! ą¤ąŠą╗čāčćą░čÄčé ą┐čāč鹥ą╝ ąŠčéąĮčÅčéąĖčÅ ą▓ąŠą┤čŗ ąŠčé čģą╗ąŠčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ čü ą┐ąŠą╝ąŠčēčīčÄ P4O10:
4HClO4 + P4O10 = 2Cl2O7 + 4HPO3
ąöąĖąŠą║čüąĖą┤ čģą╗ąŠčĆą░ ClO2 – ąČąĄą╗čéčŗą╣ ą│ą░ąĘ čü ąŠčüčéčĆčŗą╝ čģą░čĆą░ą║č鹥čĆąĮčŗą╝ ąĘą░ą┐ą░čģąŠą╝. ąÆąĘčĆčŗą▓ą░ąĄčéčüčÅ ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ. ą¤ąŠą╗čāčćą░čÄčé ąĖąĘ čģą╗ąŠčĆą░čéą░ ą║ą░ą╗ąĖčÅ ąĖ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ:
3KClO2 + 3H2SO4 = 3KHSO4 + HClO4 + H2O + 2ClO2
ą×ą║čüąĖą┤ ą┤ąĖčģą╗ąŠčĆą░ Cl2O – ą▒čāčĆčŗą╣ ą│ą░ąĘ. ąÆąĘčĆčŗą▓ąŠąŠą┐ą░čüąĄąĮ! ąĀąĄą░ą│ąĖčĆčāąĄčé čü ą▓ąŠą┤ąŠą╣ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ čģą╗ąŠčĆąĮąŠą▓ą░čéąĖčüč鹊ą╣ ą║ąĖčüą╗ąŠčéčŗ:
Cl2O + H2O = 2HClO










