ąĀą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą╝ąŠą╗ąĄą║čāą╗ą░čģ. ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé (+I, -I). ą¤čĆąĖą╝ąĄčĆčŗ. ąŁčäč乥ą║čé čüąŠą┐čĆčÅąČąĄąĮąĖčÅ (ą╝ąĄąĘąŠą╝ąĄčĆąĮčŗą╣ čŹčäč乥ą║čé: ą£, +ą£). ąÆąĖą┤čŗ ą╝ąĄąĘąŠą╝ąĄčĆąĮąŠą│ąŠ čŹčäč乥ą║čéą░ (ŽĆŽĆ, pŽĆ, ŽāŽĆ), ą┐čĆąĖą╝ąĄčĆčŗ.
ąĪą┐ąŠčüąŠą▒ąĮąŠčüčéčī ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą╝ąŠą╗ąĄą║čāą╗ ą║ čāčćą░čüčéąĖčÄ ą▓ čģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖčÅčģ čĆą░ąĘą╗ąĖčćąĮčŗčģ čéąĖą┐ąŠą▓ – čĆąĄą░ą║čåąĖąŠąĮąĮą░čÅ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčī, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮą░ ąĖčģ čüąŠčüčéą░ą▓ąŠą╝ ąĖ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮčŗą╝ čüčéčĆąŠąĄąĮąĖąĄą╝.
- ąĪąŠčüčéą░ą▓ ąĖ čüčéčĆąŠąĄąĮąĖąĄ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą╝ąŠą╗ąĄą║čāą╗ ąŠą▒čāčüą╗ąŠą▓ą╗ąĖą▓ą░čÄčé ą┐ąĄčĆąĄčĆą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ.
- ąŁą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą╗ąŠčéąĮąŠčüčéčī ą▓ čĆą░ąĘąĮčŗčģ čćą░čüčéčÅčģ ą╝ąŠą╗ąĄą║čāą╗čŗ – čĆą░ąĘąĮą░čÅ, čéą░ą║ąŠąĄ, ąĮąĄąŠą┤ąĖąĮą░ą║ąŠą▓ąŠąĄ ą┐ąĄčĆąĄčĆą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ čüąŠąĘą┤ą░ąĄčé ąĮą░ čĆą░ąĘą╗ąĖčćąĮčŗčģ čćą░čüčéčÅčģ ą╝ąŠą╗ąĄą║čāą╗čŗ, čāčćą░čüčéą║ąĖ, ąĖą╝ąĄčÄčēąĖąĄ čĆą░ąĘą╗ąĖčćąĮčŗąĄ čćą░čüčéąĖčćąĮčŗąĄ ąĘą░čĆčÅą┤čŗ – ą┐ąŠą╗čÅčĆąĖąĘąŠą▓ą░ąĮąĮčŗąĄ čāčćą░čüčéą║ąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ.
- ąśą╝ąĄąĮąĮąŠ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ ąŠčéą┤ąĄą╗čīąĮčŗčģ čāčćą░čüčéą║ąŠą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ ąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĖą▓ą░ąĄčé ąĄąĄ čĆąĄą░ą║čåąĖąŠąĮąĮčāčÄ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčī.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ čüą▓čÅąĘąĖ ąĪ-ąØ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ ą┐čĆąĖąĮčÅčéą░ čĆą░ą▓ąĮąŠą╣ 0. ąøąŠą│ąĖčćąĮąŠ, čćč鹊 ą╝ąŠą╗ąĄą║čāą╗čŗ čā ą║ąŠč鹊čĆčŗčģ ąĖą╝ąĄčÄčéčüčÅ č鹊ą╗čīą║ąŠ ąĪ-ąĪ ąĖ ąĪ-ąØ čüą▓čÅąĘąĖ – ąŠą▒ą╗ą░ą┤ą░čÄčé ą╝ąĖąĮąĖą╝ą░ą╗čīąĮąŠą╣ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčīčÄ. ąÉą╗ą║ą░ąĮčŗ – ąĖą╝ąĄąĮąĮąŠ čŹč鹊čé ą║ą╗ą░čüčü ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čüčćąĖčéą░ąĄčéčüčÅ ąĮą░ąĖą╝ąĄąĮąĄąĄ čĆąĄą░ą║čåąĖąŠąĮąĮąŠčüą┐ąŠčüąŠą▒ąĮčŗą╝. ąØąŠ čüčĆąĄą┤ąĖ ą╝ąŠą╗ąĄą║čāą╗ ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé č鹊ą╗čīą║ąŠ ąĪ-ąĪ ąĖ ąĪ-ąØ čüą▓čÅąĘąĖ č鹊ąČąĄ ąĮą░ą▒ą╗čÄą┤ą░ąĄčéčüčÅ čĆą░ąĘąĮąĖčåą░ ą▓ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą┐ąŠčüąŠą▒ąĮąŠčüčéąĖ, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮą░čÅ ŌĆŗŌĆŗą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮčŗą╝ čüčéčĆąŠąĄąĮąĖąĄą╝ ąĖ čĆą░ąĘą╝ąĄčĆą░ą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ.
ąĢčüą╗ąĖ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ ą╝ąŠą╗ąĄą║čāą╗ąĄ ą┐čĆąĖčüčāčéčüčéą▓čāčÄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĖ, ąŠčéą┤ąĄą╗čīąĮčŗąĄ ą░č鹊ą╝čŗ ąĖą╗ąĖ ą│čĆčāą┐ą┐čŗ ą░č鹊ą╝ąŠą▓, ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé ąŠčéą╗ąĖčćąĮčāčÄ ąŠčé ą░č鹊ą╝ąŠą▓ čāą│ą╗ąĄčĆąŠą┤ą░ ąĖą╗ąĖ ą▓ąŠą┤ąŠčĆąŠą┤ą░ 菹╗ąĄą║čéčĆąŠąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠčüčéčī, ąŠąĮąĖ ą▓ą╗ąĖčÅčÄčé ąĮą░ ą┐ąĄčĆąĄčĆą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ, č鹊 ąĄčüčéčī ąĮą░ ąĄąĄ čĆąĄą░ą║čåąĖąŠąĮąĮčāčÄ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčī – ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ą║ąŠč鹊čĆčŗą╣ ą┐čĆąŠčÅą▓ą╗čÅąĄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ ą╝ąŠą╗ąĄą║čāą╗čŗ.
ąÆ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠčé čéąĖą┐ą░ čģąĖą╝ąĖč湥čüą║ąĖčģ čüą▓čÅąĘąĄą╣ ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ, čĆą░ąĘą╗ąĖčćą░čÄčé:
- ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé – ą┐ąĄčĆąĄą┤ą░čćą░ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ ą▓ą╗ąĖčÅąĮąĖčÅ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ ąŠčüčāčēąĄčüčéą▓ą╗čÅąĄčéčüčÅ č湥čĆąĄąĘ čåąĄą┐čī Žā-čüą▓čÅąĘąĄą╣.
ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ąĮą░ąĖą▒ąŠą╗ąĄąĄ čüąĖą╗čīąĮąŠ ą┐čĆąŠčÅą▓ą╗čÅąĄčéčüčÅ ąĮą░ ą┐ąĄčĆą▓čŗčģ, ą▒ą╗ąĖąČą░ą╣čłąĖčģ ą║ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÄ, ą┤ą▓čāčģ ą░č鹊ą╝ą░čģ čüąŠąĄą┤ąĖąĮąĄąĮąĮčŗčģ Žā-čüą▓čÅąĘčīčÄ.
Žā-čüą▓čÅąĘčī – čŹč鹊 čüą▓čÅąĘčī ą║ąŠč鹊čĆą░čÅ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą┐čĆąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĮą░ ąŠą┤ąĮąŠą╣ ąŠčüąĖ, čüąŠąĄą┤ąĖąĮčÅčÄčēąĄą╣ ą░č鹊ą╝ąĮčŗąĄ čÅą┤čĆą░.
ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé, ą║ąŠč鹊čĆčŗą╣ ą┐čĆąŠčÅą▓ą╗čÅąĄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą╝ąŠąČąĄčé ą▒čŗčéčī ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ąĖą╗ąĖ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠ ąŠčéąĮąŠčłąĄąĮąĖčÄ ą║ ą╝ąŠą╗ąĄą║čāą╗ąĄ.
-I – ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ ąĖąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ą┐čĆąŠčÅą▓ą╗čÅąĄčéčüčÅ ą║ąŠą│ą┤ą░ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī čÅą▓ą╗čÅąĄčéčüčÅ ą▒ąŠą╗ąĄąĄ 菹╗ąĄą║čéčĆąŠąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝, č湥ą╝ ą░č鹊ą╝ą░ čāą│ą╗ąĄčĆąŠą┤ą░, ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 č湥ą│ąŠ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąŠčéčéčÅą│ąĖą▓ą░ąĄčé, ąŠčéąĮąĖą╝ą░ąĄčé ąŠčé ą╝ąŠą╗ąĄą║čāą╗čŗ 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą╗ąŠčéąĮąŠčüčéčī ąĮą░ čüąĄą▒čÅ. ą¤čĆąĖ čŹč鹊ą╝ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą┐čĆąĖąŠą▒čĆąĄčéą░ąĄčé čćą░čüčéąĖčćąĮąŠ-ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤ (╬┤-), ą░ ą░č鹊ą╝čŗ ą╝ąŠą╗ąĄą║čāą╗čŗ, ą║ąŠč鹊čĆčŗąĄ čüąŠąĄą┤ąĖąĮąĄąĮčŗ čü ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╝, ąĘą░čéčāčģą░čÄčēąĖą╣ čćą░čüčéąĖčćąĮąŠ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤ (╬┤+)
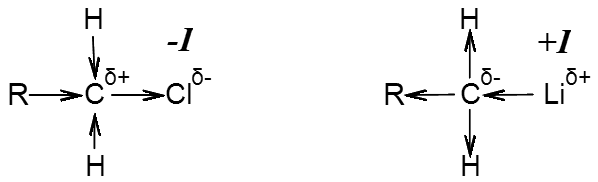
+I – ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĖąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ą┐čĆąŠčÅą▓ą╗čÅąĄčéčüčÅ ą║ąŠą│ą┤ą░ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą╝ąĄąĮąĄąĄ 菹╗ąĄą║čéčĆąŠąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ č湥ą╝ ą░č鹊ą╝ą░ čāą│ą╗ąĄčĆąŠą┤ą░, ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 č湥ą│ąŠ, ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąŠčéą┤ą░ąĄčé ąŠčé čüąĄą▒čÅ ąĖ ą┤ąŠą▒ą░ą▓ą╗čÅąĄčé ą║ ąŠčüąĮąŠą▓ąĮąŠą╣ čćą░čüčéąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą╗ąŠčéąĮąŠčüčéčī. ą¤čĆąĖ čŹč鹊ą╝ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą┐čĆąĖąŠą▒čĆąĄčéą░ąĄčé čćą░čüčéąĖčćąĮąŠ-ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤, ą░ ą░č鹊ą╝čŗ ą╝ąŠą╗ąĄą║čāą╗čŗ, ą║ąŠč鹊čĆčŗąĄ čüąŠąĄą┤ąĖąĮąĄąĮčŗ čü ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╝, ąĘą░čéčāčģą░čÄčēąĖą╣ čćą░čüčéąĖčćąĮąŠ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤.
ąØą░ ąĖąĘąŠą▒čĆą░ąČąĄąĮąĖąĖ čüčéčĆčāą║čéčāčĆąĮčŗčģ č乊čĆą╝čāą╗, ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ą┐ąŠą║ą░ąĘčŗą▓ą░čÄčé
- čüčéčĆąĄą╗ą║ą░ą╝ąĖ (ą▓ą╝ąĄčüč鹊 č湥čĆč鹊č湥ą║ ąŠą┤ąĖąĮą░čĆąĮčŗčģ čüą▓čÅąĘąĄą╣), ą║ąŠč鹊čĆčŗąĄ čāą║ą░ąĘčŗą▓ą░čÄčé ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĄ čüą╝ąĄčēąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ;
- ąĖ ą┐ąŠą╝ąĄčéą║ąŠą╣ čćą░čüčéąĖčćąĮąŠą│ąŠ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠą│ąŠ (╬┤+) ąĖą╗ąĖ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠą│ąŠ (╬┤-) ąĘą░čĆčÅą┤ą░ ą▓ ą▓ąĄčĆčģąĮąĄą╝ ąĖąĮą┤ąĄą║čüąĄ ą░č鹊ą╝ą░ čüą┐čĆą░ą▓ą░, ą║ąŠč鹊čĆčŗą╣ ą┐čĆąĖąŠą▒čĆąĄčéą░ąĄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąĖ čüą▓čÅąĘą░ąĮąĮčŗąĄ čü ąĮąĖą╝ ą░č鹊ą╝čŗ.
- ą£ąĄąĘąŠą╝ąĄčĆąĮčŗą╣ čŹčäč乥ą║čé (čŹčäč乥ą║čé čüąŠą┐čĆčÅąČąĄąĮąĖčÅ) – čŹč鹊 ą┐ąĄčĆąĄą┤ą░čćą░ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ ą▓ą╗ąĖčÅąĮąĖčÅ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ č湥čĆąĄąĘ čüąĖčüč鹥ą╝čā ŽĆ-čüą▓čÅąĘąĄą╣ ąĖą╗ąĖ čü čāčćą░čüčéąĖąĄą╝ čĆ-菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą░č鹊ą╝ąŠą▓ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣.
ą£ąĄąĘąŠą╝ąĄčĆąĮčŗą╣ čŹčäč乥ą║čé čéčĆąĄą▒čāąĄčé ąŠą▒čÅąĘą░č鹥ą╗čīąĮąŠą│ąŠ ąĮą░ą╗ąĖčćąĖčÅ čüąŠą┐čĆčÅąČąĄąĮąĮčŗčģ čāčćą░čüčéą║ąŠą▓ – čāčćą░čüčéą║ąŠą▓ čü ą┤ą▓ąŠą╣ąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ ą╝ąĄąČą┤čā ą║ąŠč鹊čĆčŗą╝ąĖ ąĮąĄ ą▒ąŠą╗čīčłąĄ ąŠą┤ąĮąŠą│ąŠ čāčćą░čüčéą║ą░ čü Žā-čüą▓čÅąĘčīčÄ, ąĖą╗ąĖ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąĖą╝ąĄčÄčēąĖą╣ čüą▓ąŠą▒ąŠą┤ąĮčŗąĄ čĆ-菹╗ąĄą║čéčĆąŠąĮčŗ.
ą£ąĄąĘąŠą╝ąĄčĆąĮčŗą╣ čŹčäč乥ą║čé ą┐ąĄčĆąĄą┤ą░ąĄčéčüčÅ ąĮą░ ą▒ąŠą╗čīčłąĄąĄ čĆą░čüčüč鹊čÅąĮąĖąĄ č湥ą╝ ąśąĮą┤čāą║čåąĖąŠąĮąĮčŗą╣ čŹčäč乥ą║čé ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ą▒ąŠą╗čīčłąĄą╣ ą┐ąŠą┤ą▓ąĖąČąĮąŠčüčéąĖ ŽĆ-čüą▓čÅąĘąĄą╣.
ŽĆ-čüą▓čÅąĘčī – čŹč鹊 čüą▓čÅąĘčī ą║ąŠč鹊čĆą░čÅ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą┐čĆąĖ ą▒ąŠą║ąŠą▓ąŠą╝ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ čĆ-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą┐ąŠ ąŠą▒ąĄ čüč鹊čĆąŠąĮčŗ ąŠčé ąŠčüąĖ, čüąŠąĄą┤ąĖąĮčÅčÄčēąĄą╣ ą░č鹊ą╝ąĮčŗąĄ čÅą┤čĆą░.
ą£ąĄąĘąŠą╝ąĄčĆąĮčŗą╣ čŹčäč乥ą║čé (čŹčäč乥ą║čé čüąŠą┐čĆčÅąČąĄąĮąĖčÅ) ą╝ąŠąČąĄčé ą▒čŗčéčī ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ąĖą╗ąĖ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝. ąĢčüą╗ąĖ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī čüą┐ąŠčüąŠą▒ąĄąĮ ą▒čŗčéčī čāčćą░čüčéąĮąĖą║ąŠą╝ čüąŠą┐čĆčÅąČąĄąĮąĮąŠą╣ čüąĖčüč鹥ą╝čŗ ąŠąĮ ą╝ąŠąČąĄčé ąĖą╗ąĖ ąŠčéčéčÅą│ąĖą▓ą░čéčī 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą╗ąŠčéąĮąŠčüčéčī čüąĖčüč鹥ą╝čŗ ąĮą░ čüąĄą▒čÅ (-ą£), ąĖą╗ąĖ ąĮą░ąŠą▒ąŠčĆąŠčé ąŠčéčéą░ą╗ą║ąĖą▓ą░čéčī 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą╗ąŠčéąĮąŠčüčéčī čüąŠą┐čĆčÅąČąĄąĮąĮąŠą╣ čüąĖčüč鹥ą╝čŗ (+ą£).
ąÜą░ą║ čĆą░čüą┐ąŠąĘąĮą░čéčī, ą║ą░ą║ąŠą╣ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą╝ąŠąČąĄčé ąŠą▒čĆą░ąĘąŠą▓čŗą▓ą░čéčī čü ą┤ą▓ąŠą╣ąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ čüąŠą┐čĆčÅąČąĄąĮąĮčŗąĄ čüąĖčüč鹥ą╝čŗ, ąĖ čŹčäč乥ą║čé ą║ą░ą║ąŠą│ąŠ ąĘąĮą░ą║ą░ ąŠąĮ ą┐čĆąŠčÅą▓ą╗čÅąĄčé?
- ąøčÄą▒ąŠą╣ ą░č鹊ą╝ ąĖą╗ąĖ ą│čĆčāą┐ą┐ą░ ą░č鹊ą╝ąŠą▓ ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé čĆ-菹╗ąĄą║čéčĆąŠąĮčŗ ąĖą╗ąĖ ą┤ą▓ąŠą╣ąĮčŗąĄ čüą▓čÅąĘąĖ čüą┐ąŠčüąŠą▒ąĮčŗ ą║ čüąŠą┐čĆčÅąČąĄąĮąĖčÄ
ąØą░ą┐čĆąĖą╝ąĄčĆ: -Cl, -Br, -NH2, -CHO, -COOH, -SO3H, -OH …
ąŠą▒ą╗ą░ą┤ą░č鹥ą╗čÅą╝ąĖ čĆ-菹╗ąĄą║čéčĆąŠąĮąŠą▓ čÅą▓ą╗čÅčÄčéčüčÅ čĆ-菹╗ąĄą╝ąĄąĮčéčŗ ą┐ąĄčĆąĖąŠą┤ąĖč湥čüą║ąŠą╣ čüąĖčüč鹥ą╝čŗ, ą░ ą▓ąŠčé s-菹╗ąĄą╝ąĄąĮčéčŗ ąĮąĄ ąĖą╝ąĄčÄčé čĆ-菹╗ąĄą║čéčĆąŠąĮąŠą▓, ą┐ąŠčŹč鹊ą╝čā ąĮąĄ čüą┐ąŠčüąŠą▒ąĮčŗ ą║ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ čüąŠą┐čĆčÅąČąĄąĮąĮčŗčģ čüąĖčüč鹥ą╝.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą║ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ čüąŠą┐čĆčÅąČąĄąĮąĮčŗčģ čüąĖčüč鹥ą╝ ąĮąĄ čüą┐ąŠčüąŠą▒ąĮčŗ: -Na, -Li, ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĖ ą▓čüąĄ čĆ-菹╗ąĄą║čéčĆąŠąĮčŗ ą║ąŠč鹊čĆčŗčģ ąĘą░ąĮčÅčéčŗ Žā-čüą▓čÅąĘčÅą╝ąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą░ą╗ą║ąĖą╗čīąĮčŗąĄ ą│čĆčāą┐ą┐čŗ: -ąĪąØ3, -ąĪąØ2-ąĪąØ3 ą┤čĆ.
- ąĢčüą╗ąĖ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī, ąĖą╝ąĄčÄčēąĖą╣ čüą▓ąŠą▒ąŠą┤ąĮčŗąĄ čĆ-菹╗ąĄą║čéčĆąŠąĮčŗ čüą▓čÅąĘą░ąĮ ąĮąĄą┐ąŠčüčĆąĄą┤čüčéą▓ąĄąĮąĮąŠ čü ą░č鹊ą╝ąŠą╝ čāą│ą╗ąĄčĆąŠą┤ą░ ą║ąŠč鹊čĆčŗą╣ ąĖą╝ąĄąĄčé ą┤ą▓ąŠą╣ąĮčāčÄ čüą▓čÅąĘčī, čŹč鹊čé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą┐čĆąŠčÅą▓ą╗čÅąĄčé +ą£ čŹčäč乥ą║čé:
ąĢčüą╗ąĖ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī – ą│čĆčāą┐ą┐ą░ ą░č鹊ą╝ąŠą▓, ą░ ą░č鹊ą╝ čüą▓čÅąĘą░ąĮąĮčŗą╣ čü čāą│ą╗ąĄčĆąŠą┤ąŠą╝ Žā-čüą▓čÅąĘčīčÄ ąĖą╝ąĄąĄčé čĆ-菹╗ąĄą║čéčĆąŠąĮčŗ čüą▓čÅąĘą░ąĮčŗ ą┤ą▓ąŠą╣ąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ čü ą┤čĆčāą│ąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą│čĆčāą┐ą┐čŗ, č鹊 ąŠąĮ ą┐čĆąŠčÅą▓ą╗čÅąĄčé -ą£ čŹčäč乥ą║čé, č鹊 ąĄčüčéčī ąŠčéčéčÅą│ąĖą▓ą░ąĄčé 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą╗ąŠčéąĮąŠčüčéčī čüąŠą┐čĆčÅąČąĄąĮąĮąŠą╣ čüąĖčüč鹥ą╝čŗ ąĮą░ čüąĄą▒čÅ:
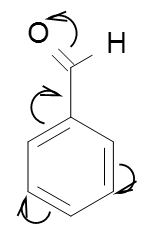
ąÆ ą▒ąĄąĮąĘąŠą╗čīąĮąŠą╝ ą║ąŠą╗čīčåąĄ, ą▓ą╗ąĖčÅąĮąĖąĄ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣ ąŠą▒čāčüą╗ąŠą▓ą╗ąĖą▓ą░ąĄčé ąŠčĆąĖąĄąĮčéą░čåąĖčÄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ą┤čĆčāą│ąĖčģ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣.
ąĢčüą╗ąĖ ą▒ąĄąĮąĘąŠą╗ ąĖą╝ąĄąĄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą║ąŠč鹊čĆčŗą╣ ą┐čĆąŠčÅą▓ą╗čÅąĄčé +ą£ čŹčäč乥ą║čé, ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┤čĆčāą│ąĖčģ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣ ą┐ąŠ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą╝čā ą╝ąĄčģą░ąĮąĖąĘą╝čā ą┐čĆąĄąĖą╝čāčēąĄčüčéą▓ąĄąĮąĮąŠ ą┐čĆąŠčģąŠą┤ąĖčé ą▓ ąŠčĆč鹊 ąĖ ą┐ą░čĆą░ ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ.
ąĢčüą╗ąĖ ą▒ąĄąĮąĘąŠą╗ ąĖą╝ąĄąĄčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ą║ąŠč鹊čĆčŗą╣ ą┐čĆąŠčÅą▓ą╗čÅąĄčé -ą£ čŹčäč乥ą║čé, ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣ ą┐ąŠ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą╝čā ą╝ąĄčģą░ąĮąĖąĘą╝čā ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░ąĄčé ą▓ ą╝ąĄčéą░ ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ.










