ąÉą╗ą║ą░ą┤č¢čöąĮąĖ (ą┤č¢čöąĮąĖ, ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ) CnH2n-2
ąöč¢čöąĮąĖ – čåąĄ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ, čÅą║č¢ ą▓ čüą║ą╗ą░ą┤č¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą╝ą░čÄčéčī ą┤ą▓ą░ ą┐ąŠą┤ą▓č¢ą╣ąĮč¢ ąĘą▓’čÅąĘą║ąĖ ą╝č¢ąČ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā.
ą×čüą║č¢ą╗čīą║ąĖ ą┤ą╗čÅ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą┤ą▓ąŠčģ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ąĮąĄąŠą▒čģč¢ą┤ąĮąŠ ą┐čĆąĖąĮą░ą╣ą╝ąĮč¢ čéčĆąĖ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā, ą▓ čåčīąŠą╝čā čĆčÅą┤čā ą│ąŠą╝ąŠą╗ąŠą│ąĖ ąĘ ąŠą┤ąĮąĖą╝ č¢ ą┤ą▓ąŠą╝ą░ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ąĮąĄ č¢čüąĮčāčÄčéčī.
ąÉą╗ą║ą░ą┤č¢čöąĮąĖ ą▓ ą┐čĆąĖčĆąŠą┤č¢
ąÆ ą┐čĆąĖčĆąŠą┤č¢ ą░ą╗ą║ą░ą┤č¢čöąĮąĖ ąĘčāčüčéčĆč¢čćą░čÄčéčīčüčÅ ą▓ čüąŠą║čā ą┤ąĄčÅą║ąĖčģ čĆąŠčüą╗ąĖąĮ (ą│ąĄą▓ąĄčÅ, ą║čāą╗čīą▒ą░ą▒ą░ čéą░ č¢ąĮ.).
ąåąĘąŠą╝ąĄčĆč¢čÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąöą╗čÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓, čéą░ą║ čüą░ą╝ąŠ čÅą║ č¢ ą░ą╗ą║ąĄąĮč¢ą▓, čģą░čĆą░ą║č鹥čĆąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą│ąŠ čüą║ąĄą╗ąĄčéčā č¢ čåąĖčü-čéčĆą░ąĮčü-č¢ąĘąŠą╝ąĄčĆč¢čÅ.
ąŚą░ą╗ąĄąČąĮąŠ ą▓č¢ą┤ ą▓ąĘą░čöą╝ąĮąŠą│ąŠ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓, ą┤č¢čöąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ą╝ąŠąČąĮą░ čĆąŠąĘą┤č¢ą╗ąĖčéąĖ ąĮą░ čéčĆąĖ ąŠčüąĮąŠą▓ąĮč¢ čéąĖą┐ąĖ:
- ąÜą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ąĘ ą║čāą╝čāą╗čīąŠą▓ą░ąĮąĖą╝ąĖ (ą┐čĆąĖą╝ąĖą║ą░čÄčéčī ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā) ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ – ą░ą╗ąĄąĮ (H2C=C=CH2) č¢ ą╣ąŠą│ąŠ ą│ąŠą╝ąŠą╗ąŠą│ąĖ;
- ąÜą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ąĘ čüą┐čĆčÅąČąĄąĮąĖą╝ąĖ (ą║ąŠąĮ’čÄą│ąŠą▓ą░ąĮąĖą╝ąĖ) ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ – ą┤ąĖą▓č¢ąĮč¢ą╗ (H2C=CH-CH=CH2) č¢ ą╣ąŠą│ąŠ ą│ąŠą╝ąŠą╗ąŠą│ąĖ;
- ąÜą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ąĘ č¢ąĘąŠą╗čīąŠą▓ą░ąĮąĖą╝ąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ (H2C=CH-CH2-CH=CH2).
ąöč¢čöąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ą┐ąĄčĆčłąĖčģ ą┤ą▓ąŠčģ čéąĖą┐č¢ą▓ ą┐čĆąŠčÅą▓ą╗čÅčÄčéčī čüą┐ąĄčåąĖčäč¢čćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢. ąöą╗čÅ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ čéčĆąĄčéčīąŠą│ąŠ čéąĖą┐čā čģą░čĆą░ą║č鹥čĆąĮč¢ ąĘą▓ąĖčćą░ą╣ąĮč¢ čĆąĄą░ą║čåč¢čŚ ąĄč鹥ąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓, ą▓ čéą░ą║ąĖčģ čĆąĄą░ą║čåč¢čÅčģ ą▒ąĄčĆčāčéčī čāčćą░čüčéčī ąĮąĄ ąŠą┤ąĖąĮ, ą░ ąŠą▒ąĖą┤ą▓ą░ ąĘą▓’čÅąĘą║ąĖ ąĘ ą▒č¢ą╗čīčłąŠčÄ ą░ą▒ąŠ ą╝ąĄąĮčłąŠčÄ čüąĄą╗ąĄą║čéąĖą▓ąĮč¢čüčéčÄ.
ąØąŠą╝ąĄąĮą║ą╗ą░čéčāčĆą░ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąöč¢čöąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ąĘą░ čüąĖčüč鹥ą╝ą░čéąĖčćąĮąŠčÄ ąĮąŠą╝ąĄąĮą║ą╗ą░čéčāčĆąŠčÄ ąĮą░ąĘąĖą▓ą░čÄčéčī čéą░ą║ čüą░ą╝ąŠ, čÅą║ č¢ ąĄč鹥ąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ; ąĘą░ą╝č¢čüčéčī čüčāčäč¢ą║čüą░ -ąĄąĮ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī čüčāčäč¢ą║čü -ą┤č¢čöąĮ (ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą┤ą▓ą░). ą¤ąŠą╗ąŠąČąĄąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą┐ąŠą║ą░ąĘčāčÄčéčī čåąĖčäčĆą░ą╝ąĖ. ąöą╗čÅ ą┤ąĄčÅą║ąĖčģ ą┤č¢čöąĮč¢ą▓ ąĘą▒ąĄčĆąĄą│ą╗ąĖčüčÅ čéčĆąĖą▓č¢ą░ą╗čīąĮč¢ ą░ą▒ąŠ čüčéą░čĆč¢ čĆą░čåč¢ąŠąĮą░ą╗čīąĮč¢ ąĮą░ąĘą▓ąĖ:
ą┐čĆąŠą┐-1,2-ą┤č¢čöąĮ, ą░ą╗ąĄąĮ
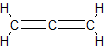
ą▒čāčé-1,2-ą┤č¢čöąĮ, ą╝ąĄčéč¢ą╗ą░ą╗ąĄąĮ
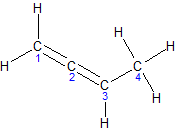
ą▒čāčé-1,3-ą┤č¢čöąĮ, ą┤ąĖą▓č¢ąĮč¢ą╗

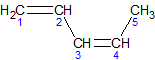
2-ą╝ąĄčéąĖą╗ą▒čāčéą░-1,3-ą┤č¢čöąĮ, č¢ąĘąŠą┐čĆąĄąĮ
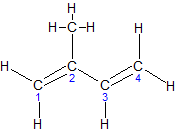
ą┐ąĄąĮčé-1,3-ą┤č¢čöąĮ, ą┐č¢ą┐ąĄčĆąĖą╗ąĄąĮ
2,3-ą┤ąĖą╝ąĄčéąĖą╗ą▒čāčé-1,3-ą┤č¢čöąĮ
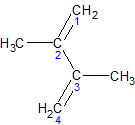
ą×čüąŠą▒ą╗ąĖą▓ąŠčüčéč¢ ą▒čāą┤ąŠą▓ąĖ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąÆ ą╝ąŠą╗ąĄą║čāą╗č¢ ą░ą╗ą║ą░ą┤č¢čöąĮąĖ ąĘ ą║čāą╝čāą╗čīąŠą▓ą░ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ ŽĆ-ąĘą▓’čÅąĘą║ąĖ čĆąŠąĘčéą░čłąŠą▓čāčÄčéčīčüčÅ ą▓ ą┤ą▓ąŠčģ ą▓ąĘą░čöą╝ąĮąŠ ą┐ąĄčĆą┐ąĄąĮą┤ąĖą║čāą╗čÅčĆąĮąĖčģ ą┐ą╗ąŠčēąĖąĮą░čģ. ą¤ą╗ąŠčēąĖąĮą░, ą▓ čÅą║ąĖčģ čĆąŠąĘčéą░čłąŠą▓čāčÄčéčīčüčÅ ą┤ą▓č¢ ą┐ą░čĆąĖ ą░č鹊ą╝č¢ą▓ ą│č¢ą┤čĆąŠą│ąĄąĮčā, čéą░ą║ąŠąČ ą▓ąĘą░čöą╝ąĮąŠ ą┐ąĄčĆą┐ąĄąĮą┤ąĖą║čāą╗čÅčĆąĮč¢. ąöą▓ą░ ą║čĆą░ą╣ąĮč¢čģ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā ą║čāą╝čāą╗čīą▓ą░ąĮąŠčŚ čüąĖčüč鹥ą╝ąĖ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ čüčéą░ąĮč¢ sčĆ2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ, čüąĄčĆąĄą┤ąĮč¢ą╣ ą░č鹊ą╝ ą║ą░čĆą▒ąŠąĮčā ą▓ sp-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ.
ą”č¢ ąŠčüąŠą▒ą╗ąĖą▓ąŠčüčéč¢ ą║ą▓ą░ąĮč鹊ą▓ąŠ-ą╝ąĄčģą░ąĮč¢čćąĮąŠčŚ ą▒čāą┤ąŠą▓ąĖ ą┐čĆąŠčÅą▓ą╗čÅčÄčéčīčüčÅ ą▓ čäč¢ąĘąĖčćąĮąĖčģ čéą░ čģč¢ą╝č¢čćąĮąĖčģ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéčÅčģ ą┤č¢čöąĮč¢ą▓. ąŚąŠą║čĆąĄą╝ą░, ą▓ čĆčÅą┤č¢ ą┤č¢čöąĮč¢ą▓ ą┐čĆąĖ ą┤ą▓ąŠčģ čĆč¢ąĘąĮąĖčģ ąĘą░ą╝č¢čüąĮąĖą║ą░čģ ąĮą░ ą║č¢ąĮčåąĄą▓ąĖčģ ą░č鹊ą╝ą░čģ ą║ą░čĆą▒ąŠąĮčā ą╝ąŠąČą╗ąĖą▓ą░ ąŠą┐čéąĖčćąĮą░ ą░ą║čéąĖą▓ąĮč¢čüčéčī ąĘą░ą▓ą┤čÅą║ąĖ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮč¢ą╣ ą░čüąĖą╝ąĄčéčĆč¢čŚ. ąöą▓ą░ ą┐čĆąŠčüč鹊čĆąŠą▓ąĖčģ č¢ąĘąŠą╝ąĄčĆąĖ, čēąŠ ą▓č¢ą┤ąĮąŠčüčÅčéčīčüčÅ ąŠą┤ąĖąĮ ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ čÅą║ ą┐čĆąĄą┤ą╝ąĄčé ą┤ąŠ čüą▓ąŠą│ąŠ ą┤ąĘąĄčĆą║ą░ą╗čīąĮąŠą│ąŠ ąĘąŠą▒čĆą░ąČąĄąĮąĮčÅ, ą┐čĆąĖ ąĮą░ą║ą╗ą░ą┤ą░ąĮąĮč¢ ąŠą┤ąĖąĮ ąĮą░ ąŠą┤ąĮąŠą│ąŠ ąĮąĄ ąĘą▒č¢ą│ą░čÄčéčīčüčÅ, ąŠčéąČąĄ, čÅą▓ą╗čÅčÄčéčī čüąŠą▒ąŠčÄ ą┤ą▓č¢ čĆč¢ąĘąĮč¢ č¢ąĘąŠą╝ąĄčĆąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ.
ąöą╗čÅ ą┤č¢čöąĮč¢ą▓ čģą░čĆą░ą║č鹥čĆąĮč¢ ą╗ąĄą│ą║č¢čüčéčī ą│č¢ą┤čĆą░čéą░čåč¢čŚ čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮąŠčÄ čüčāą╗čīčäą░čéąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą║ąĄč鹊ąĮč¢ą▓, ąĘą┤ą░čéąĮč¢čüčéčī ą┤ąŠ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą░ą▒ąŠ ą║ąŠąĮą┤ąĄąĮčüą░čåč¢čŚ ąĘ č¢ąĮčłąĖą╝ąĖ ąĮąĄąĮą░čüąĖč湥ąĮąĖą╝ąĖ čüą┐ąŠą╗čāą║ą░ą╝ąĖ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ č湊čéąĖčĆąĖčćą╗ąĄąĮąĮąĖčģ čåąĖą║ą╗č¢ą▓.
ą×čéčĆąĖą╝ą░ąĮąĮčÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąĪą┐ąŠčüąŠą▒ąĖ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ 1,3-ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓.
ąĪą┐ąŠčüąŠą▒ąĖ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ čĆčÅą┤čā ą┤ąĖą▓č¢ąĮč¢ą╗čā ą▓ ą▒č¢ą╗čīčłąŠčüčéč¢ ą▓ąĖą┐ą░ą┤ą║č¢ą▓ ąĮąĄ ą▓č¢ą┤čĆč¢ąĘąĮčÅčÄčéčīčüčÅ ą▓č¢ą┤ čüą┐ąŠčüąŠą▒č¢ą▓ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓, ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮč¢ čĆąĄą░ą║čåč¢čŚ ąĮąĄąŠą▒čģč¢ą┤ąĮąŠ ą┐čĆąŠą▓ąŠą┤ąĖčéąĖ ą┤ą▓č¢čćč¢ ą░ą▒ąŠ ą▓ čÅą║ąŠčüčéč¢ ą▓ąĖčģč¢ą┤ąĮąŠčŚ čĆąĄč湊ą▓ąĖąĮąĖ ąĘą░čüč鹊čüąŠą▓čāą▓ą░čéąĖ čüą┐ąŠą╗čāą║ąĖ, čēąŠ ą▓ąČąĄ ą╝č¢čüčéčÅčéčī ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║.
1. ąöąĖą▓č¢ąĮč¢ą╗ čéą░ č¢ąĘąŠą┐čĆąĄąĮ ąŠą┤ąĄčĆąČčāčÄčéčī ą▓ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąŠčüčéč¢ ą┤ąĄą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘą░čåč¢čöčÄ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą▒čāčéą░ąĮ-ą▒čāčéąĖą╗ąĄąĮąŠą▓ąĖčģ ą░ą▒ąŠ č¢ąĘąŠą┐ąĄąĮčéą░ąĮ-ą░ą╝č¢ą╗ąĄąĮąŠą▓ąĖčģ čüčāą╝č¢čłąĄą╣ ąĘą░ąĘą▓ąĖčćą░ą╣ ąĮą░ą┤ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ą╝ąĖ, čēąŠ ą╝č¢čüčéčÅčéčī Cr2O3:
H3C-CH2-CH2-CH3 ŌåÆ H3C-CH=CH-CH3 ŌåÆ H2C=CH-CH=CH2
H3C-CH(CH3)-CH2CH3 ŌåÆ H3C-C(CH3)=CH-CH3 ŌåÆ H2C=C(CH3)-CH=CH2
2. ąöąĖą▓č¢ąĮč¢ą╗, č¢ąĘąŠą┐čĆąĄąĮ, ą┤ąĖč¢ąĘąŠą┐čĆąŠą┐ąĄąĮč¢ą╗ (ą▓ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąĖčģ ą╝ą░čüčłčéą░ą▒ą░čģ) ąŠčéčĆąĖą╝čāčÄčéčī ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čöčÄ ą│ą╗č¢ą║ąŠą╗ąĄą╣:
H3C-CHOH-CH2-CH2OH ŌåÆ H2C=CH-CH=CH2 + H2O
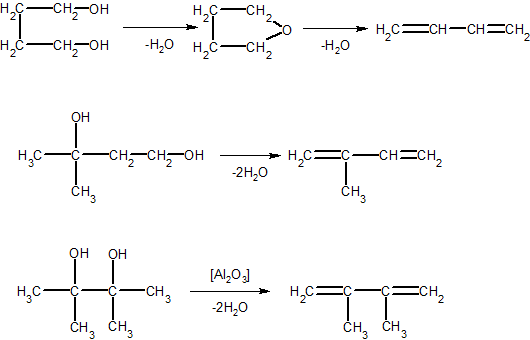
3. ąÉą╗ą║ą░ą┤č¢čöąĮąĖ ąŠčéčĆąĖą╝čāčÄčéčī čéą░ą║ąŠąČ ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čöčÄ ąĮąĄąĮą░čüąĖč湥ąĮąĖčģ čüą┐ąĖčĆčéč¢ą▓, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ą┤ąĖą▓č¢ąĮč¢ą╗ ąŠčéčĆąĖą╝čāčÄčéčī ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čöčÄ ą║čĆąŠčéč¢ą╗ąŠą▓ąŠą│ąŠ čüą┐ąĖčĆčéčā:
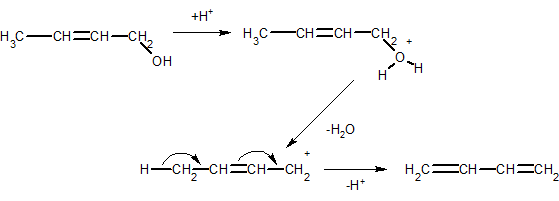
4. ą¤ą░čĆąĖ ąĄčéąĖą╗ąŠą▓ąŠą│ąŠ čüą┐ąĖčĆčéčā ą┐čĆąŠą┐čāčüą║ą░čÄčéčī ąĮą░ą┤ ą┤ąĄą│č¢ą┤čĆčāčÄčćąĖą╝ąĖ čéą░ ą┤ąĄą│č¢ą┤čĆą░čéčāčÄčćąĖą╝ąĖ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ą╝ąĖ, ą▓ čĆąĄąĘčāą╗čīčéą░čéč¢ č湊ą│ąŠ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┤ąĖą▓č¢ąĮč¢ą╗ ąĘ ą▓ąĖčģąŠą┤ąŠą╝ ą▒č¢ą╗čīčłąĄ 70% (ą▓č¢ą┤ č鹥ąŠčĆąĄčéąĖčćąĮąŠą│ąŠ):
2H3C-CH2-OH ŌåÆ H2C=CH-CH-CH2 + 2H2O + H2
ążč¢ąĘąĖčćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąöąĖą▓č¢ąĮč¢ą╗ ą┐čĆąĖ ąĘą▓ąĖčćą░ą╣ąĮąĖčģ čāą╝ąŠą▓ą░čģ – ą│ą░ąĘ. ąśąĘąŠą┐čĆąĄąĮ č¢ č¢ąĮčłč¢ ąĮą░ą╣ą┐čĆąŠčüčéč¢čłč¢ ą░ą╗ą║ą░ą┤č¢čöąĮąĖ – čĆč¢ą┤ąĖąĮąĖ. ąŚą▓ąĖčćą░ą╣ąĮč¢ ąĘą░ą║ąŠąĮąŠą╝č¢čĆąĮąŠčüčéč¢, ą▓ą╗ą░čüčéąĖą▓č¢ ą│ąŠą╝ąŠą╗ąŠą│č¢čćąĮąŠą╝čā čĆčÅą┤čā ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓, ą┤č¢čÄčéčī č¢ ą▓ čĆčÅą┤č¢ ą┤č¢čöąĮč¢ą▓.
ąöą╗čÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ ąĘ čüą┐ąŠą╗čāč湥ąĮąĖą╝ąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ čģą░čĆą░ą║č鹥čĆąĮč¢ ą░ąĮąŠą╝ą░ą╗čīąĮąŠ ą▓ąĖčüąŠą║č¢ ą┐ąŠą║ą░ąĘąĮąĖą║ąĖ ąĘą░ą╗ąŠą╝ą╗ąĄąĮąĮčÅ čüą▓č¢čéą╗ą░. ąŚą░ą▓ą┤čÅą║ąĖ čåč¢ą╣ ąŠčüąŠą▒ą╗ąĖą▓ąŠčüčéč¢ ąĘąĮą░ą╣ą┤ąĄąĮč¢ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮč¢ čĆąĄčäčĆą░ą║čåč¢čŚ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ ąĘąĮą░čćąĮąŠ ą▒č¢ą╗čīčłč¢ ąĘą░ čĆąŠąĘčĆą░čģčāąĮą║ąŠą▓č¢. ąĀč¢ąĘąĮąĖčåčÅ ą╝č¢ąČ ąĘąĮą░ą╣ą┤ąĄąĮąĖą╝ąĖ č¢ čĆąŠąĘčĆą░čģąŠą▓ą░ąĮąĖą╝ąĖ ą▓ąĄą╗ąĖčćąĖąĮą░ą╝ąĖ čüčéą░ąĮąŠą▓ąĖčéčī ąĘą░ąĘą▓ąĖčćą░ą╣ 1-1,5 ąŠą┤ąĖąĮąĖčåčī. ąÆąŠąĮą░ ąĮą░ąĘąĖą▓ą░čöčéčīčüčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░ ąĄą║ąĘą░ą╗čīčéą░čåč¢čÅ.
ąÉą╗ą║ą░ą┤č¢čöąĮąĖ ą┐ąŠą│ą╗ąĖąĮą░čÄčéčī čāą╗čīčéčĆą░čäč¢ąŠą╗ąĄč鹊ą▓ąĄ ą▓ąĖą┐čĆąŠą╝č¢ąĮčÄą▓ą░ąĮąĮčÅ ą▓ ąĘąĮą░čćąĮąŠ ą▒č¢ą╗čīčł ą┤ąŠą▓ą│ąŠčģą▓ąĖą╗čīąŠą▓č¢ą╣ ąŠą▒ą╗ą░čüčéč¢, ąĮč¢ąČ ą░ą╗ą║ąĄąĮąĖ. ąØą░ą┐čĆąĖą║ą╗ą░ą┤, 1,3-ą▒čāčéą░ą┤č¢čöąĮ ą┐ąŠą│ą╗ąĖąĮą░čö ą┐čĆąĖ 217 ąĮą╝. ąØą░ą║ąŠą┐ąĖč湥ąĮąĮčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗č¢ čüą┐čĆčÅąČąĄąĮąĖčģ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą▓ąĄą┤ąĄ ą┤ąŠ ą┐ąŠą┤ą░ą╗čīčłąŠą│ąŠ ąĘčüčāą▓čā ą╝ą░ą║čüąĖą╝čāą╝čā ą┐ąŠą│ą╗ąĖąĮą░ąĮąĮčÅ ąĘ čāą╗čīčéčĆą░čäč¢ąŠą╗ąĄč鹊ą▓ąŠčŚ ąŠą▒ą╗ą░čüčéč¢ ą▓ ą▓ąĖą┤ąĖą╝čā ąŠą▒ą╗ą░čüčéčī: ą┐čĆąĖ č湊čéąĖčĆčīąŠčģ čüą┐ąŠą╗čāč湥ąĮąĖčģ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║ą░čģ, ąĘ’čÅą▓ą╗čÅčöčéčīčüčÅ ąČąŠą▓č鹥 ąĘą░ą▒ą░čĆą▓ą╗ąĄąĮąĮčÅ.
ąÆ ąåąÜ-čüą┐ąĄą║čéčĆą░čģ ą┤ą╗čÅ 1,3-ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ čģą░čĆą░ą║č鹥čĆąĮąŠ ąĘąĮąĖąČąĄąĮąĮčÅ čćą░čüč鹊čéąĖ č¢ ąĘą▒č¢ą╗čīčłąĄąĮąĮčÅ č¢ąĮč鹥ąĮčüąĖą▓ąĮąŠčüčéč¢ čüą╝čāą│ąĖ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ą║ąŠą╗ąĖą▓ą░ąĮčī ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ (ą┐čĆąĖą▒ą╗ąĖąĘąĮąŠ ą┤ąŠ 1600 čüą╝-1).
ąźč¢ą╝č¢čćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ ą░ą╗ą║ą░ą┤ąĖąĄąĮąŠą▓
ąźč¢ą╝č¢čćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ 1,3-ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓.
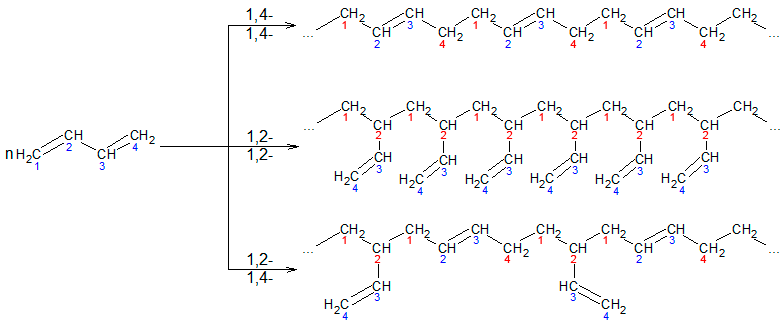
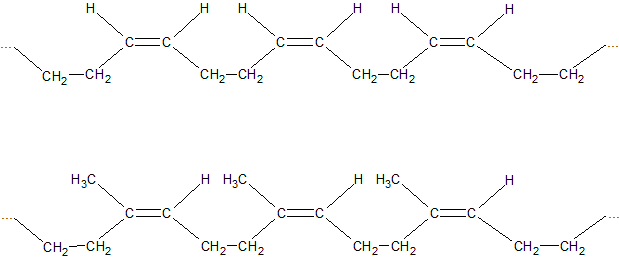
ąöą▓ą░ čüą┐čĆčÅąČąĄąĮč¢ ŽĆ-ąĘą▓ŌĆÖčÅąĘą║ąĖ čāčéą▓ąŠčĆčÄčÄčéčī ąĘą░ą│ą░ą╗čīąĮčā ąĄą╗ąĄą║čéčĆąŠąĮąĮčā čģą╝ą░čĆčā – ą▓čüč¢ č湊čéąĖčĆąĖ ą░č鹊ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ čüčéą░ąĮč¢ sp2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ. ą”ąĄ ą┐čĆąĖąĘą▓ąŠą┤ąĖčéčī ą┤ąŠ ą▓ą║ąŠčĆąŠč湥ąĮąĮčÅ ą┐čĆąŠčüč鹊ą│ąŠ ąĘą▓’čÅąĘą║čā (ą┤ąŠ 0,146 ąĮą╝) č¢ ą┤ąŠ čüčéą░ą▒č¢ą╗č¢ąĘą░čåč¢čŚ ą╝ąŠą╗ąĄą║čāą╗ąĖ. ąóą░ą║, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ąĄąĮąĄčĆą│č¢čÅ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┤ąĖą▓č¢ąĮč¢ą╗čā ąĮą░ 14,6 ą║ąöąČ/ą╝ąŠą╗čī ą▒č¢ą╗čīčłąĄ ą▓ ą┐ąŠčĆč¢ą▓ąĮčÅąĮąĮč¢ ąĘ čĆąŠąĘčĆą░čģąŠą▓ą░ąĮąŠčÄ ąĄąĮąĄčĆą│č¢čöčÄ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮčā č鹊ą│ąŠ ąČ čüą║ą╗ą░ą┤čā, ą░ą╗ąĄ ą▒ąĄąĘ čāčĆą░čģčāą▓ą░ąĮąĮčÅ čüą┐ąŠą╗čāč湥ąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓. ą”čÄ čĆč¢ąĘąĮąĖčåčÄ ąĮą░ąĘąĖą▓ą░čÄčéčī ąĄąĮąĄčĆą│č¢čÅ čĆąĄąĘąŠąĮą░ąĮčüčā. ą”čÅ ąŠčüąŠą▒ą╗ąĖą▓č¢čüčéčī ą▓ ą▒čāą┤ąŠą▓č¢ ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ čĆąŠą▒ąĖčéčī čŚčģ ąĘą┤ą░čéąĮąĖą╝ąĖ ą┐čĆąĖčöą┤ąĮčāą▓ą░čéąĖ č¢ąĮčłč¢ ą░č鹊ą╝ąĖ ąĮąĄ čéč¢ą╗čīą║ąĖ ą┐ąŠ ąŠą┤ąĮąŠą╝čā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓, ą░ ą╣ ą┤ąŠ ą║čĆą░ą╣ąĮč¢čģ ą░č鹊ą╝č¢ą▓ ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ ąĘ ą┐ąĄčĆąĄą╝č¢čēąĄąĮąĮčÅą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā.
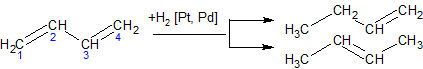
ąōč¢ą┤čĆčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓. ąÜą░čéą░ą╗č¢čéąĖčćąĮąŠ ąĘą▒čāą┤ąČąĄąĮąĖą╣ ą▓ąŠą┤ąĄąĮčī (Pt, Pd) ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ą▓ 1,2- č¢ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ:
ąōą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ (ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│ą░ą╗ąŠą│ąĄąĮč¢ą▓). ąōą░ą╗ąŠą│ąĄąĮąĖ ą╝ąŠąČčāčéčī ą┐čĆąĖčöą┤ąĮčāą▓ą░čéąĖčüčÅ ą┤ąŠ ąĘą▓’čÅąĘą░ąĮąĖčģ čüąĖčüč鹥ą╝ ą▓ 1,2- č¢ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ, ą┐čĆąĖč湊ą╝čā ą║č¢ą╗čīą║č¢čüčéčī 1,4-ą┐čĆąŠą┤čāą║čéčā ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą▒čāą┤ąŠą▓ąĖ ą┤č¢čöąĮąŠą▓ąŠą│ąŠ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮčā, ą┐čĆąĖčĆąŠą┤ąĖ ą│ą░ą╗ąŠą│ąĄąĮčā č¢ čāą╝ąŠą▓ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮčÅ čģč¢ą╝č¢čćąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ. ąÆąĖčģč¢ą┤ ą┐čĆąŠą┤čāą║čéčā 1,4-ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ąĘčĆąŠčüčéą░čö ą┐čĆąĖ ą┐č¢ą┤ą▓ąĖčēąĄąĮąĮč¢ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ (ą▓ ą┐ąĄą▓ąĮąĖčģ ą╝ąĄąČą░čģ) ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤č¢ ą▓č¢ą┤ čģą╗ąŠčĆčā ą┤ąŠ ą╣ąŠą┤čā:

ą¤čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą╝ąŠąČąĄ ą▓č¢ą┤ą▒čāą▓ą░čéąĖčüčÅ ąĘą░ č¢ąŠąĮąĮąĖą╝ ą░ą▒ąŠ ąĘą░ čĆą░ą┤ąĖą║ą░ą╗čīąĮąĖą╝ ą╝ąĄčģą░ąĮč¢ąĘą╝ąŠą╝.
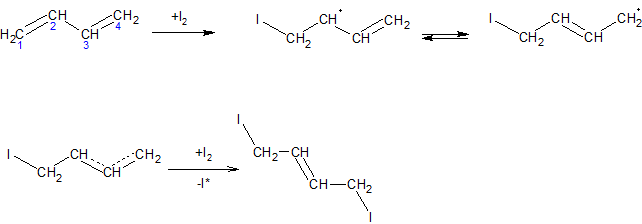
ą¤čĆąĖ č¢ąŠąĮąĮąŠą╝čā ą╝ąĄčģą░ąĮč¢ąĘą╝č¢ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ čģą╗ąŠčĆčā, čüą┐ąŠčćą░čéą║čā ą▓ąĖąĮąĖą║ą░čö ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čü (I) čłą▓ąĖą┤ą║ąŠ ą┐ąĄčĆąĄčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓ ą┐ąŠą▓’čÅąĘą░ąĮąĖą╣ ą║ą░čĆą▒ąĄąĮč¢ą╣-čģą╗ąŠčĆąŠąĮč¢čöą▓ąĖą╣ č¢ąŠąĮ ąĘ ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╝ ąĘą░čĆčÅą┤ąŠą╝ ąĮą░ C2 č¢ C4 ą░č鹊ą╝ą░čģ, čÅą║ąĖą╣ ą╝ąŠąČąĮą░ ąĘąŠą▒čĆą░ąĘąĖčéąĖ ą┤ą▓ąŠą╝ą░ ą│čĆą░ąĮąĖčćąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ (II) ą░ą▒ąŠ ąŠą┤ąĮč¢čöčÄ ą╝ąĄąĘąŠą╝ąĄčĆąĮąŠčÄ č乊čĆą╝čāą╗ąŠčÄ (III). ą”ąĄą╣ č¢ąŠąĮ ą┐čĆąĖčöą┤ąĮčāčö ą┤ą░ą╗č¢ ą░ąĮč¢ąŠąĮ čģą╗ąŠčĆčā ą▓ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ 2 č¢ 4 ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą┐čĆąŠą┤čāą║čéč¢ą▓ 1,2- č¢ 1,4-ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ. ą×čüčéą░ąĮąĮč¢, ą▓ čüą▓ąŠčÄ č湥čĆą│čā, ą╝ąŠąČčāčéčī ą┐č¢ą┤ą┤ą░ą▓ą░čéąĖčüčÅ č¢ąĘąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ čā ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąĖčģ čāą╝ąŠą▓ą░čģ č¢ ą┐ąĄčĆąĄčéą▓ąŠčĆčÄą▓ą░čéąĖčüčÅ ąŠą┤ąĖąĮ ąĮą░ č¢ąĮčłąĖą╣ ą┤ąŠ ą┤ąŠčüčÅą│ąĮąĄąĮąĮčÅ čüčéą░ąĮčā čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ č湥čĆąĄąĘ č鹊ą╣ čüą░ą╝ąĖą╣ ą┐čĆąŠą╝č¢ąČąĮąĖą╣ ą║ą░čĆą▒ąĄąĮč¢čöą▓ąĖą╣ č¢ąŠąĮ:
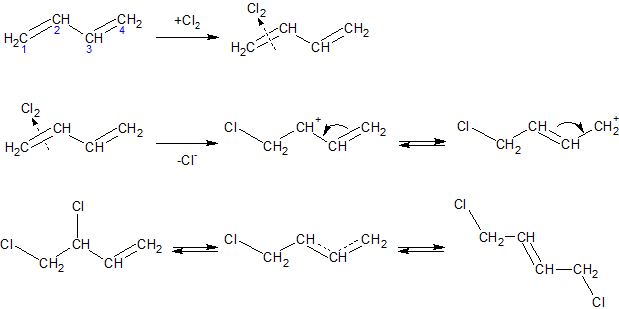
ą»ą║čēąŠ ą▓ čāą╝ąŠą▓ą░čģ čĆąĄą░ą║čåč¢čŚ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ čüąĖčüč鹥ą╝ą░ ą▒ą╗ąĖąĘčīą║ą░ ą┤ąŠ čüčéą░ąĮčā čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ, ą▓ą╝č¢čüčé ą║ąŠąČąĮąŠą│ąŠ č¢ąĘąŠą╝ąĄčĆčā ą▓ ą┐čĆąŠą┤čāą║čéą░čģ čĆąĄą░ą║čåč¢čŚ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ. ąŚą░ąĘą▓ąĖčćą░ą╣ 1,4-ą┐čĆąŠą┤čāą║čé ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠ ą▒č¢ą╗čīčł ą▓ąĖą│č¢ą┤ąĮąĖą╣ č¢ č鹊ą╝čā ą┐ąĄčĆąĄą▓ą░ąČą░čö.
ąØą░ą▓ą┐ą░ą║ąĖ, ą║ąŠą╗ąĖ čüąĖčüč鹥ą╝ą░ ą┤ą░ą╗ąĄą║ą░ ą▓č¢ą┤ čüčéą░ąĮčā čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ, ą╝ąŠąČąĄ čāčéą▓ąŠčĆčÄą▓ą░čéąĖčüčÅ ą┐ąĄčĆąĄą▓ą░ąČąĮąŠ 1,2-ą┐čĆąŠą┤čāą║čé, čÅą║čēąŠ ąĄąĮąĄčĆą│č¢čÅ ą░ą║čéąĖą▓ą░čåč¢čŚ ą▓ čĆąĄą░ą║čåč¢čŚ ą╣ąŠą│ąŠ čāčéą▓ąŠčĆąĄąĮąĮčÅ ąĮąĖąČčćą░, ąĮč¢ąČ ą▓ čĆąĄą░ą║čåč¢čŚ čāčéą▓ąŠčĆąĄąĮąĮčÅ 1,4-ą┐čĆąŠą┤čāą║čéčā. ąóą░ą║, ą▓ čĆą░ąĘč¢ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ čģą╗ąŠčĆčā ą┤ąŠ ą┤č¢ą▓č¢ąĮč¢ą╗čā ą▓ąĖčģąŠą┤ąĖčéčī ą┐čĆąĖą▒ą╗ąĖąĘąĮąŠ čĆč¢ą▓ąĮą░ ą║č¢ą╗čīą║č¢čüčéčī 1,2- č¢ 1,4-ą┤č¢čģą╗ąŠčĆą▒čāč鹥ąĮč¢ą▓, ą▓ čĆą░ąĘč¢ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą▒čĆąŠą╝čā ą▓ąĖčģąŠą┤ąĖčéčī ą▒ą╗ąĖąĘčīą║ąŠ 66% 1,4-ą┐čĆąŠą┤čāą║čéčā, ąŠčüą║č¢ą╗čīą║ąĖ ąĘą▓’čÅąĘąŠą║ C-Br ą╝ąĄąĮčł ą╝č¢čåąĮąĖą╣, ąĮč¢ąČ ąĘą▓’čÅąĘąŠą║ C-Cl, č¢ čĆč¢ą▓ąĮąŠą▓ą░ą│ą░ ą┤ą╗čÅ ą▒čĆąŠą╝č¢ą┤čā ą┤ąŠčüčÅą│ą░čöčéčīčüčÅ ą╗ąĄą│čłąĄ. ą¤č¢ą┤ą▓ąĖčēąĄąĮąĮčÅ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ ąĮą░ą▒ą╗ąĖąČą░čö čüąĖčüč鹥ą╝čā ą┤ąŠ čĆč¢ą▓ąĮąŠą▓ą░ąČąĮąŠą│ąŠ čüčéą░ąĮčā.
ą¤čĆąĖ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā ą┐čĆąĖčöą┤ąĮą░ąĮąĮč¢ ą░č鹊ą╝ą░ ą│ą░ą╗ąŠą│ąĄąĮčā čāčéą▓ąŠčĆčÄčöčéčīčüčÅ čüą┐čĆčÅąČąĄąĮąĖą╣ čĆą░ą┤ąĖą║ą░ą╗, čÅą║ąĖą╣ čéą░ą║ąŠąČ ą╝ą░čö čĆąĄą░ą║čåč¢ą╣ąĮčā ąĘą┤ą░čéąĮč¢čüčéčī ą▓ ąŠą▒ąĖą┤ą▓ą░ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ, ą┐čĆąŠč鹥 čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐ąĄčĆąĄą▓ą░ąČąĮąŠ 1,4-ą░ą┤ą┤čāą║čé:
ąĢą╗ąĄą║čéčĆąŠčäč¢ą╗čīąĮąĄ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ čģą╗ąŠčĆčā ą┤ąŠ ą▒čāčéą░ą┤č¢čöąĮčā ą▓ čĆą░ą╝ą║ą░čģ č鹥ąŠčĆč¢čŚ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą╝ąŠąČąĄ ą▒čāčéąĖ ąŠą┐ąĖčüą░ąĮąŠ ąĮą░čüčéčāą┐ąĮąĖą╝ čćąĖąĮąŠą╝.
ą£ąŠą╗ąĄą║čāą╗ą░ ą▒čāčéą░ą┤č¢čöąĮčā ą╝ą░čö ą┤ą▓ą░ ŽĆ-ąĘą▓’čÅąĘą║ąĖ, ąŠčéąČąĄ, č湊čéąĖčĆąĖ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮč¢ ŽĆ-ąŠčĆą▒č¢čéą░ą╗č¢ (ą┤ą▓č¢ ąĘą▓’čÅąĘčāčÄčćč¢ č¢ ą┤ą▓č¢ čĆąŠąĘą┐čāčłčāčÄčćč¢).
ąØą░čÅą▓ąĮč¢čüčéčī ąŠčĆą▒č¢čéą░ą╗č¢ ąĘ ąĮąĖąĘčīą║ąŠčÄ ąĄąĮąĄčĆą│č¢čöčÄ Žł1 č¢ ą┐ąĄčĆąĄą║čĆąĖą▓ą░ąĮąĮčÅą╝ ą▓čüč¢čģ č湊čéąĖčĆčīąŠčģ ŽĆ-ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą┐ąŠčÅčüąĮčÄčö čŚčŚ ą┐č¢ą┤ą▓ąĖčēąĄąĮčā čüčéč¢ą╣ą║č¢čüčéčī.
ą¤čĆąĖ ąĘč¢čéą║ąĮąĄąĮąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▒čāčéą░ą┤č¢čöąĮčā ąĘ ą╝ąŠą╗ąĄą║čāą╗ąŠčÄ čģą╗ąŠčĆčā ą▓ąĖčēą░ ąĘą░ą╣ąĮčÅčéą░ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░ ąŠčĆą▒č¢čéą░ą╗čī ą▒čāčéą░ą┤č¢čöąĮčā Žł2 ą┐ąĄčĆąĄą║čĆąĖą▓ą░čöčéčīčüčÅ ąĘ ą▓č¢ą╗čīąĮąŠčÄ ą░č鹊ą╝ąĮąŠčÄ ąŠčĆą▒č¢čéą░ą╗ą╗čÄ Cl+ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ąĘą▓’čÅąĘą║čā C-Cl č¢ ąĘą▓č¢ą╗čīąĮąĄąĮąĮčÅą╝ Cl–. ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ ą▓ąĖąĮąĖą║ą░čö ą║ą░čĆą▒ąĄąĮč¢čöą▓ąĖą╣ č¢ąŠąĮ ąĘ ą┤ą▓ąŠą╝ą░ ąĄą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ąĮą░ čéčĆčīąŠčģ ŽĆ-ąŠčĆą▒č¢čéą░ą╗čÅčģ, ąŠą┤ąĮą░ ąĘ čÅą║ąĖčģ (Žł2) ą╝ą░čö ąĮą░ ą┤čĆčāą│ąŠą╝čā ą░č鹊ą╝č¢ ą║ą░čĆą▒ąŠąĮčā ą▓čāąĘąŠą╗.
ą”ąĄą╣ č¢ąŠąĮ ą┤ą░ą╗č¢ ą▓ąĘą░čöą╝ąŠą┤č¢čö ąĘ č¢ąŠąĮąŠą╝ čģą╗ąŠčĆčā: ą▓ąĖčēą░ ąĘą░ą╣ąĮčÅčéą░ ąŠčĆą▒č¢čéą░ą╗čī čåčīąŠą│ąŠ č¢ąŠąĮčā ą┐ąĄčĆąĄą║čĆąĖą▓ą░čöčéčīčüčÅ ąĘ ąĮąĖąČč湊čÄ ą▓ą░ą║ą░ąĮčéąĮąŠčÄ ąŠčĆą▒č¢čéą░ą╗ą╗čÄ č¢ąŠąĮą░. ą¤čĆąĖ čåčīąŠą╝čā ąĮąŠą▓ąĖą╣ ąĘą▓’čÅąĘąŠą║ C-Cl ą╝ąŠąČąĄ čāčéą▓ąŠčĆčÄą▓ą░čéąĖčüčÅ ą░ą▒ąŠ ąĘ ą░č鹊ą╝ąŠą╝ C1, ą░ą▒ąŠ ąĘ ą░č鹊ą╝ąŠą╝ C2.
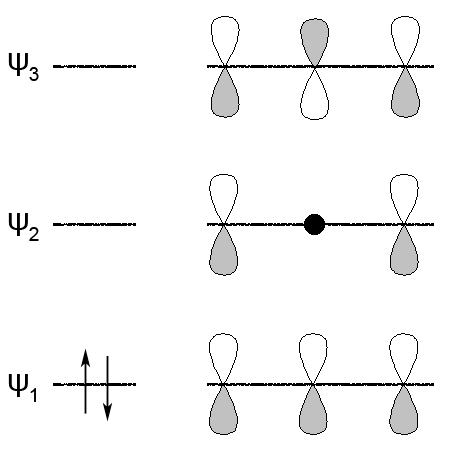
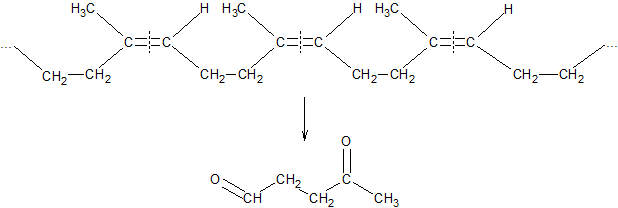
ąōč¢ą┤čĆąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą┤č¢čöąĮč¢ą▓. ąÆ čĆąĄą░ą║čåč¢čÅčģ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓ ą┤č¢čÄčéčī čéą░ą║č¢ čüą░ą╝č¢ ąĘą░ą║ąŠąĮąŠą╝č¢čĆąĮąŠčüčéč¢:

ąōč¢ą┐ąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą┤č¢čöąĮč¢ą▓. ąōč¢ą┐ąŠą│ą░ą╗ąŠą│ąĄąĮąĮč¢ ą║ąĖčüą╗ąŠčéąĖ č¢ čŚčģ ąĄč鹥čĆąĖ ą┐čĆąĖčöą┤ąĮčāčÄčéčīčüčÅ ą┐ąĄčĆąĄą▓ą░ąČąĮąŠ ą▓ 1,2-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ. ąĪąĖčüč鹥ą╝ą░ ą▓ ą╝ąŠą╝ąĄąĮčé čĆąĄą░ą║čåč¢čŚ ąŠčüąŠą▒ą╗ąĖą▓ąŠ ą┤ą░ą╗ąĄą║ą░ ą▓č¢ą┤ čüčéą░ąĮčā čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ (ąĘą▓’čÅąĘąŠą║ C-O ąĘąĮą░čćąĮąŠ ą╝č¢čåąĮč¢čłąĖą╣ ąĘą░ ąĘą▓’čÅąĘą║ąĖ C-Hlg), ą░ ąĄąĮąĄčĆą│č¢čÅ ą░ą║čéąĖą▓ą░čåč¢čŚ ą▓ čĆąĄą░ą║čåč¢čŚ čāčéą▓ąŠčĆąĄąĮąĮčÅ 1,2 ą┐čĆąŠą┤čāą║čéčā ąĮąĖąČčćą░, ąĮč¢ąČ ą▓ čĆąĄą░ą║čåč¢čŚ čāčéą▓ąŠčĆąĄąĮąĮčÅ 1,4-ą┐čĆąŠą┤čāą║čéčā:
ąöąĖą╝ąĄčĆąĖąĘą░čåč¢čÅ ą┤č¢čöąĮč¢ą▓. ą¤čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ ąĘą┤ą░čéąĮč¢ ą┐čĆąĖčöą┤ąĮčāą▓ą░čéąĖčüčÅ ąŠą┤ąĖąĮ ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ čéą░ą║ąĖą╝ čćąĖąĮąŠą╝, čēąŠ ąŠą┤ąĮą░ ąĘ ąĮąĖčģ čĆąĄą░ą│čāčö ą▓ 1,2, ą░ č¢ąĮčłą░ ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ. ą×ą┤ąĮąŠčćą░čüąĮąŠ ą▓ ąĮąĄą▓ąĄą╗ąĖą║ąĖčģ ą║č¢ą╗čīą║ąŠčüčéčÅčģ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą┐čĆąŠą┤čāą║čé ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ąŠą▒ąŠčģ ą╝ąŠą╗ąĄą║čāą╗ ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ:

ąÆ čéą░ą║č¢ą╣ čĆąĄą░ą║čåč¢čŚ ą┤ąĖą╝ąĄčĆąĖąĘą░čåč¢čŚ ą┐čĆąĖą╣ą╝ą░čÄčéčī čāčćą░čüčéčī č¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ čĆč¢ąĘąĮąĖčģ ą┤č¢čöąĮč¢ą▓:
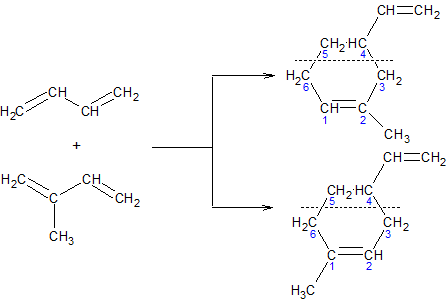
ąöč¢čöąĮąŠą▓ąĖą╣ čüąĖąĮč鹥ąĘ. ą×čüąŠą▒ą╗ąĖą▓ąŠ ą╗ąĄą│ą║ąŠ čĆąĄą░ą║čåč¢čŚ ą┤ąĖą╝ąĄčĆąĖąĘą░čåč¢čŚ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ ą╣ą┤čāčéčī ą▓ č鹊ą╝čā ą▓ąĖą┐ą░ą┤ą║čā, ą║ąŠą╗ąĖ ąŠą┤ąĮą░ ąĘ čĆąĄą░ą│čāčÄčćąĖčģ ą╝ąŠą╗ąĄą║čāą╗ ą╝ą░čö ą░ą║čéąĖą▓ąŠą▓ą░ąĮąĖą╣ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║, ąĄą╗ąĄą║čéčĆąŠčäč¢ą╗čīąĮč¢čüčéčī čÅą║ąŠą│ąŠ ą┐č¢ą┤ą▓ąĖčēąĄąĮą░ ąĘą░ą▓ą┤čÅą║ąĖ čüą┐ąŠą╗čāč湥ąĮąĮčÄ ąĘ ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ. ą¤ąŠą┤č¢ą▒ąĮč¢ čĆąĄą░ą║čåč¢čŚ ąŠčéčĆąĖą╝ą░ą╗ąĖ ąĮą░ąĘą▓čā ą┤č¢čöąĮąŠą▓ąĖą╣ čüąĖąĮč鹥ąĘ ą░ą▒ąŠ čĆąĄą░ą║čåč¢čÅ ąöč¢ą╗čīčüą░-ąÉą╗čīą┤ąĄčĆą░:
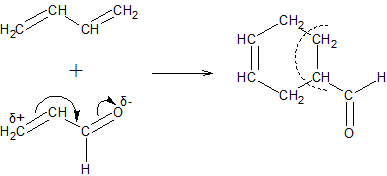
ą”čÅ čĆąĄą░ą║čåč¢čÅ čłąĖčĆąŠą║ąŠ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą┤ą╗čÅ čÅą║č¢čüąĮąŠą│ąŠ č¢ ą║č¢ą╗čīą║č¢čüąĮąŠą│ąŠ ą▓ąĖąĘąĮą░č湥ąĮąĮčÅ ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓, ą░ čéą░ą║ąŠąČ ą┤ą╗čÅ čüąĖąĮč鹥ąĘčā čĆč¢ąĘąĮąĖčģ čüą┐ąŠą╗čāą║ ąĘ čłąĄčüčéąĖčćą╗ąĄąĮąĮąĖą╝ąĖ čåąĖą║ą╗ą░ą╝ąĖ.
ąĀąĄą░ą║čåč¢čŚ ą┤č¢čöąĮąŠą▓ąŠą│ąŠ čüąĖąĮč鹥ąĘčā č¢ ą┤č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ ą╣ą┤čāčéčī č湥čĆąĄąĘ čåąĖą║ą╗č¢čćąĮąĖą╣ ą┐ąĄčĆąĄčģč¢ą┤ąĮąĖą╣ čüčéą░ąĮ ąĘ ąŠą┤ąĮąŠčćą░čüąĮąĖą╝ ą░ą▒ąŠ ą╝ą░ą╣ąČąĄ ąŠą┤ąĮąŠčćą░čüąĮąĖą╝ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ąŠą▒ąŠčģ ąĮąŠą▓ąĖčģ ąĘą▓’čÅąĘą║č¢ą▓, č鹊ą▒č鹊 čÅą║ ą┐ąĄčĆąĄčåąĖą║ą╗č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ.
ą£ąŠąČą╗ąĖą▓č¢čüčéčī č¢ čāą╝ąŠą▓ąĖ ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ ą┐ąŠą┤č¢ą▒ąĮąĖčģ čĆąĄą░ą║čåč¢ą╣ čåąĖą║ą╗č¢ąĘą░čåč¢čŚ, čēąŠ ą┐čĆąŠčģąŠą┤čÅčéčī ą▒ąĄąĘ ą┐čĆąŠą╝č¢ąČąĮąŠą│ąŠ čāčéą▓ąŠčĆąĄąĮąĮčÅ čĆą░ą┤ąĖą║ą░ą╗č¢ą▓ ą░ą▒ąŠ č¢ąŠąĮč¢ą▓, ą┐č¢ą┤ą║ąŠčĆčÅčÄčéčīčüčÅ ąĘą░ą║ąŠąĮąŠą╝č¢čĆąĮąŠčüčéčÅą╝ ą┐č¢ą┤ ąĮą░ąĘą▓ąŠčÄ ą┐čĆą░ą▓ąĖą╗ą░ ąÆčāą┤ą▓ąŠčĆčéą░-ąōąŠčäą╝ą░ąĮą░. ąŚą│č¢ą┤ąĮąŠ ąĘ ą┐čĆą░ą▓ąĖą╗ą░ą╝ąĖ ąÆčāą┤ą▓ąŠčĆčéą░-ąōąŠčäą╝ą░ąĮą░, ą┤ą╗čÅ č鹊ą│ąŠ čēąŠą▒ ąĘą░ą╝ą║ąĮčāą▓čüčÅ čåąĖą║ą╗, ąŠčĆą▒č¢čéą░ą╗č¢, čēąŠ čāčéą▓ąŠčĆčÄčÄčéčī ąĮąŠą▓č¢ ąĘą▓’čÅąĘą║ąĖ, ą┐ąŠą▓ąĖąĮąĮč¢ ą╝ą░čéąĖ ą╝ąŠąČą╗ąĖą▓č¢čüčéčī ą┐ąĄčĆąĄą║čĆąĖčéąĖčüčÅ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ąĘą▓’čÅąĘčāčÄčćąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣, č鹊ą▒č鹊 ą┐ąŠą▓ąĖąĮąĮč¢ ą▒čāčéąĖ čüą┐čĆčÅą╝ąŠą▓ą░ąĮč¢ ąŠą┤ąĖąĮ ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ čüąĄą│ą╝ąĄąĮčéą░ą╝ąĖ ąŠą┤ąĮą░ą║ąŠą▓ąŠą│ąŠ ąĘąĮą░ą║ą░.
ą»ą║čēąŠ ą┤ą╗čÅ čåčīąŠą│ąŠ ąĮąĄ ą┐ąŠčéčĆč¢ą▒ąĮąĄ ąĘą▒čāąČą┤ąĄąĮąĮčÅ ą▒čāą┤čī-čÅą║ąŠčŚ ąĘ čĆąĄą░ą│čāčÄčćąĖčģ ą╝ąŠą╗ąĄą║čāą╗ (ą┐ąĄčĆąĄčģč¢ą┤ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ąĮą░ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║ąĖą╣ čĆč¢ą▓ąĄąĮčī ąĘč¢ ąĘą╝č¢ąĮąŠčÄ ąĘąĮą░ą║ą░ čüąĄą│ą╝ąĄąĮčéč¢ą▓), č鹊 ą┐čĆąŠčåąĄčü ą┤ąŠąĘą▓ąŠą╗ąĄąĮąĖą╣ ą┐ąŠ čüąĖą╝ąĄčéčĆč¢čŚ čÅą║ č鹥čĆą╝č¢čćąĮąĖą╣ ą┐čĆąŠčåąĄčü, č鹊ą▒č鹊 čĆąĄą░ą║čåč¢čÅ ą▒čāą┤ąĄ ą╣čéąĖ ą░ą▒ąŠ ą┐čĆąĖčüą║ąŠčĆčÄą▓ą░čéąĖčüčÅ ą┐čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢. ą»ą║čēąŠ ą┤ą╗čÅ ąĘą░ąĘąĮą░č湥ąĮąŠčŚ ą▓ąĖčēąĄ ąŠčĆč¢čöąĮčéą░čåč¢čŚ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ąĮąĄąŠą▒čģč¢ą┤ąĮąŠ ą┐ąĄčĆąĄą▓ąĄčüčéąĖ ąĄą╗ąĄą║čéčĆąŠąĮąĖ ąŠą┤ąĮč¢čöčŚ ąĘ ą╝ąŠą╗ąĄą║čāą╗ ąĮą░ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║ąĖą╣ čĆč¢ą▓ąĄąĮčī (ąĮą░ čĆąŠąĘą┐čāčłčāčÄčćčā ąŠčĆą▒č¢čéą░ą╗čī), čĆąĄą░ą║čåč¢čÅ ą┤ąŠąĘą▓ąŠą╗ąĄąĮą░ ą┐ąŠ čüąĖą╝ąĄčéčĆč¢čŚ čéč¢ą╗čīą║ąĖ čÅą║ č乊č鹊čģč¢ą╝č¢čćąĮąĖą╣ ą┐čĆąŠčåąĄčü.
ąĀąĄą░ą║čåč¢čŚ ą┤č¢čöąĮąŠą▓ąŠą│ąŠ čüąĖąĮč鹥ąĘčā ą┐čĆąŠčéč¢ą║ą░čÄčéčī čÅą║ č鹥čĆą╝č¢čćąĮąĖą╣ ą┐čĆąŠčåąĄčü.
ąØą░ ą┐čĆąŠčéąĖą▓ą░ą│čā ą┤č¢čöąĮąŠą▓ąŠą╝čā čüąĖąĮč鹥ąĘčā ąĘą░ą╝ąĖą║ą░ąĮąĮčÅ ą┤ą▓ąŠčģ ą╝ąŠą╗ąĄą║čāą╗ ą░ą╗ą║ąĄąĮčā ą▓ č湊čéąĖčĆąĖčćą╗ąĄąĮąĮąĖą╣ čåąĖą║ą╗ ąĮąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ čÅą║ č鹥čĆą╝č¢čćąĮąĖą╣ ą┐čĆąŠčåąĄčü, ą┤ą╗čÅ ąĘą┤č¢ą╣čüąĮąĄąĮąĮčÅ čéą░ą║ąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĮąĄąŠą▒čģč¢ą┤ąĮąŠ ąĘą▒čāą┤ąČąĄąĮąĮčÅ ą╝ąŠą╗ąĄą║čāą╗ ąĘą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ čāą╗čīčéčĆą░čäč¢ąŠą╗ąĄč鹊ą▓ąŠą│ąŠ ą▓ąĖą┐čĆąŠą╝č¢ąĮčÄą▓ą░ąĮąĮčÅ.
ąĀąĄą░ą║čåč¢čŚ ą┤č¢čöąĮąŠą▓ąŠą│ąŠ čüąĖąĮč鹥ąĘčā ą╝ąŠąČčāčéčī ą╣čéąĖ čéą░ą║ąŠąČ č¢ ą┐ąŠ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā č¢ ą┐ąŠ ą║ą░čéą░ą╗č¢čéąĖčćąĮąŠą╝čā ą╝ąĄčģą░ąĮč¢ąĘą╝ą░ą╝ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą┐čĆąŠą╝č¢ąČąĮąĖčģ čćą░čüčéąĖąĮąŠą║. ąöąŠ čĆąĄą░ą║čåč¢ą╣ ą┤č¢čöąĮąŠą▓ąŠą│ąŠ čüąĖąĮč鹥ąĘčā, čÅą║č¢ ą╣ą┤čāčéčī ą┐ąŠ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā ą░ą▒ąŠ ą┐ąŠ ą║ą░čéą░ą╗č¢čéąĖčćąĮąŠą╝čā ą╝ąĄčģą░ąĮč¢ąĘą╝čā, ą┐čĆą░ą▓ąĖą╗ą░ ąÆčāą┤ą▓ąŠčĆčéą░-ąōąŠčäą╝ą░ąĮą░ ą▓č¢ą┤ąĮąŠčłąĄąĮąĮčÅ ąĮąĄ ą╝ą░čÄčéčī.
ąóąĄą╗ąŠą╝ąĄčĆąĖąĘą░čåč¢čÅ ą┤č¢čöąĮč¢ą▓. ąÆč¢ą┤ąŠą╝č¢ čĆąĄą░ą║čåč¢čŚ č鹥ą╗ąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓ ąĘ ą│ą░ą╗ąŠą│ąĄąĮą┐ąŠčģč¢ą┤ąĮąĖą╝ąĖ, ą▓ąŠą┤ąŠčÄ, čüą┐ąĖčĆčéą░ą╝ąĖ, ą║ąĖčüą╗ąŠčéą░ą╝ąĖ, ą░ą╝č¢ąĮą░ą╝ąĖ č¢ č¢ąĮ., ąØą░ą┐čĆąĖą║ą╗ą░ą┤:
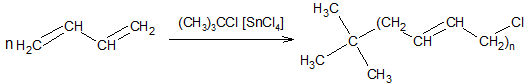
ąĀąĄą░ą║čåč¢čŚ č鹥ą╗ąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčīčüčÅ ą▓ ą▒ą░ą│ą░č鹊čüčéą░ą┤č¢ą╣ąĮąŠą╝čā čüąĖąĮč鹥ąĘč¢ ą░ą╗č¢čäą░čéąĖčćąĮąĖčģ č¢ ą╝ąŠąĮąŠčåąĖą║ą╗č¢čćąĮąĖčģ č鹥čĆą┐ąĄąĮč¢ą▓.
ą¤ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą┤č¢čöąĮč¢ą▓. ąÆą░ąČą╗ąĖą▓ąŠčÄ ąŠčüąŠą▒ą╗ąĖą▓č¢čüčéčÄ ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ ąĘ čüą┐čĆčÅąČąĄąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ čö čŚčģ ąĘą┤ą░čéąĮč¢čüčéčī ą┤ąŠ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą▓ ą║ą░čāčćčāą║ąŠą┐ąŠą┤č¢ą▒ąĮč¢ ą┐čĆąŠą┤čāą║čéąĖ.
ą©ą▓ąĖą┤ą║č¢čüčéčī ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą▒čāą┤ąŠą▓ąĖ ą┤č¢čöąĮč¢ą▓ č¢ ąĘąŠą▓ąĮč¢čłąĮč¢čģ čāą╝ąŠą▓. ąŚą░ą╝č¢čüąĮąĖą║ąĖ ą▓čüąĄčĆąĄą┤ąĖąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┐ąŠą╗ąĄą│čłčāčÄčéčī, ą░ ąĮą░ ą║č¢ąĮčåč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ, čāčüą║ą╗ą░ą┤ąĮčÄčÄčéčī ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÄ: ąĖąĘąŠą┐čĆąĄąĮ ą┐ąŠą╗ąĖą╝ąĄčĆąĖąĘčāąĄčéčüčÅ čłą▓ąĖą┤čłąĄ, ą┐č¢ą┐ąĄčĆąĖą╗ąĄąĮ ą┐ąŠą▓č¢ą╗čīąĮč¢čłąĄ, ąĮč¢ąČ ą┤ąĖą▓č¢ąĮč¢ą╗. ą¤čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ č¢ ą┐č¢ą┤ čéąĖčüą║ąŠą╝ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą┐čĆąĖčüą║ąŠčĆčÄčöčéčīčüčÅ.
ą¤čĆąŠą╝ąĖčüą╗ąŠą▓ąĖą╣ č¢ąĮč鹥čĆąĄčü ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčö ą╗ą░ąĮčåčÄą│ąŠą▓ą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą┤č¢čöąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ ą┐č¢ą┤ ą▓ą┐ą╗ąĖą▓ąŠą╝ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ ą░ą▒ąŠ č¢ąĮč¢čåč¢ą░č鹊čĆč¢ą▓. ąÆ čÅą║ąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą╗čāąČąĮč¢ ą╝ąĄčéą░ą╗ąĖ, ą╝ąĄčéą░ą╗ąŠąŠčĆą│ą░ąĮč¢čćąĮč¢ čüą┐ąŠą╗čāą║ąĖ, čÅą║ č¢ąĮč¢čåč¢ą░č鹊čĆąĖ – ąŠčĆą│ą░ąĮč¢čćąĮč¢ č¢ ąĮąĄąŠčĆą│ą░ąĮč¢čćąĮč¢ ą┐ąĄčĆąŠą║čüąĖą┤ąĖ.
ą¤čĆąĖ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ąŠą║čĆąĄą╝č¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą╝ąŠąĮąŠą╝ąĄčĆč¢ą▓ ą╝ąŠąČčāčéčī ąĘ’čöą┤ąĮčāą▓ą░čéąĖčüčÅ ąŠą┤ąĮą░ ąĘ ąŠą┤ąĮąŠčÄ ą▓ 1,2, ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮč¢ ą░ą▒ąŠ ąŠą┤ąĮą░ ą╝ąŠą╗ąĄą║čāą╗ą░ čĆąĄą░ą│čāčö ą▓ 1,2, ą░ č¢ąĮčłą░ ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮč¢:
ąĪč鹥čĆąĄąŠčĆąĄą│čāą╗čÅčĆąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ (ą┐čĆąŠčüč鹊čĆąŠą▓ąŠ ą▓ą┐ąŠčĆčÅą┤ą║ąŠą▓ą░ąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ) ą▓ 1,4-ą┐ąŠą╗ąŠąČąĄąĮąĮč¢ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ čåąĖčü-ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čŚ ą║ąŠąČąĮąŠą│ąŠ ąĘą░ą╗ąĖčłą║čā, ą┤ą░čö ą┐ąŠą╗č¢ą╝ąĄčĆąĖ ąĘ ąĮą░ą╣ą▒č¢ą╗čīčł čåč¢ąĮąĮąĖą╝ąĖ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéčÅą╝ąĖ. ąĪč鹥čĆąĄąŠčĆąĄą│čāą╗čÅčĆąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą╣ą┤ąĄ ąĮą░ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░čģ, ą┐čĆąĖą│ąŠč鹊ą▓ą░ąĮąĖčģ ąĮą░ ąŠčüąĮąŠą▓č¢ ą╝ąĄčéą░ą╗ąŠąŠčĆą│ą░ąĮč¢čćąĮąĖčģ čüą┐ąŠą╗čāą║, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą░ą╗čÄą╝č¢ąĮč¢ą╣ ą░ą▒ąŠ ą╗č¢čéč¢ą╣ąŠčĆą│ą░ąĮč¢čćąĮąĖčģ (ąÜ. ą”ąĖą│ą╗ąĄčĆ, ąöąČ. ąØą░čéčéą░):
ąóą░ą║ąŠąČ, ą┤č¢čöąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ą┐čĆąĖą╣ą╝ą░čÄčéčī čāčćą░čüčéčī ą▓ čĆąĄą░ą║čåč¢čÅčģ čüąŠą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ąĘ č¢ąĮčłąĖą╝ąĖ ą╝ąŠąĮąŠą╝ąĄčĆą░ą╝ąĖ – čüčéąĖčĆąŠą╗, ą░ą║čĆąĖą╗ąŠąĮč¢čéčĆąĖą╗ č¢ č¢ąĮ.
ąŚą░čüč鹊čüčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ą░ą┤č¢čöąĮč¢ą▓
ąØą░čéčāčĆą░ą╗čīąĮąĖą╣ č¢ čüąĖąĮč鹥čéąĖčćąĮąĖą╣ ą║ą░čāčćčāą║ąĖ.
ąØą░čéčāčĆą░ą╗čīąĮąĖą╣ ą║ą░čāčćčāą║ ą▓ąĖą┤ąŠą▒čāą▓ą░čöčéčīčüčÅ ąĘ čüąŠą║čā ą┤ąĄčÅą║ąĖčģ čĆąŠčüą╗ąĖąĮ. ąöąŠ ą║ą░čāčćčāą║ąŠą▓ąĖčģ čĆąŠčüą╗ąĖąĮ ąĮą░ą╗ąĄąČą░čéčī ą│ąĄą▓ąĄčÅ, ą│ą▓ą░čÄą╗ą░, ą║ąŠą║-čüą░ą│ąĖąĘ, čéą░čā-čüą░ą│ąĖąĘ, ąĘą▓ąĖčćą░ą╣ąĮą░ ą║čāą╗čīą▒ą░ą▒ą░. ą¤čĆąŠą╝ąĖčüą╗ąŠą▓ąĄ ąĘąĮą░č湥ąĮąĮčÅ ą╝ą░čö ą▓ ą┤ą░ąĮąĖą╣ čćą░čü ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ąĮą░čéčāčĆą░ą╗čīąĮąŠą│ąŠ ą║ą░čāčćčāą║čā čéč¢ą╗čīą║ąĖ ąĮą░ ąŠčüąĮąŠą▓č¢ ą║čāą╗čīčéąĖą▓ąŠą▓ą░ąĮąĖčģ ą┐ą╗ą░ąĮčéą░čåč¢ą╣ čéčĆąŠą┐č¢čćąĮąŠą│ąŠ ą┤ąĄčĆąĄą▓ą░ ą│ąĄą▓ąĄčÅ.
ąŚą░ čģč¢ą╝č¢čćąĮąĖą╝ čüą║ą╗ą░ą┤ąŠą╝ č¢ ą▒čāą┤ąŠą▓ąŠčÄ ąĮą░čéčāčĆą░ą╗čīąĮąĖą╣ ą║ą░čāčćčāą║ čåąĄ čüč鹥čĆąĄąŠčĆąĄą│čāą╗čÅčĆąĮąĖą╣ čåąĖčü-ą┐ąŠą╗č¢ą╝ąĄčĆ č¢ąĘąŠą┐čĆąĄąĮčā. ąóčĆą░ąĮčü-ą┐ąŠą╗č¢ą╝ąĄčĆ č¢ąĘąŠą┐čĆąĄąĮčā ąĘčāčüčéčĆč¢čćą░čöčéčīčüčÅ ą▓ ą┐čĆąĖčĆąŠą┤č¢ ą┐č¢ą┤ ąĮą░ąĘą▓ąŠčÄ ą│čāčéą░ą┐ąĄčĆčćą░.
ąæčāą┤ąŠą▓čā ą║ą░čāčćčāą║čā ą▒čāą╗ąŠ ą▓ąĖąĘąĮą░č湥ąĮąŠ ą╝ąĄč鹊ą┤ąŠą╝ ąŠąĘąŠąĮčāą▓ą░ąĮąĮčÅ (ąōą░čĆčĆč¢čöčü). ą×čéčĆąĖą╝ą░ąĮąĖą╣ ą┐čĆąĖ ąŠąĘąŠąĮąŠą╗č¢ąĘč¢ ą╗ąĄą▓čāą╗č¢ąĮąŠą▓ąĖą╣ ą░ą╗čīą┤ąĄą│č¢ą┤ ą┐č¢ą┤čéą▓ąĄčĆą┤ąČčāčö ą▓ą┐ąŠčĆčÅą┤ą║ąŠą▓ą░ąĮčā 1,4-ą▒čāą┤ąŠą▓čā:
ąØąĄą▒ą░ą│ą░č鹊 ą║čĆą░茹Į ą╝ą░čÄčéčī ą╝ąŠąČą╗ąĖą▓č¢čüčéčī ą▓ąĖčĆąŠą▒ą╗čÅčéąĖ ąĮą░čéčāčĆą░ą╗čīąĮąĖą╣ ą║ą░čāčćčāą║. ąÆ ąŠčüąĮąŠą▓ąĮąŠą╝čā ą┐čĆąĖčĆąŠą┤ąĮąĖą╣ ą║ą░čāčćčāą║ ąĘą░ą╝č¢ąĮčÄčÄčéčī čüąĖąĮč鹥čéąĖčćąĮąĖą╝. ąĪąĖąĮč鹥čéąĖčćąĮč¢ ą║ą░čāčćčāą║ąĖ ą▓ąĖčĆąŠą▒ą╗čÅčÄčéčī ąĮą░ ąŠčüąĮąŠą▓č¢ ąĮą░čüčéčāą┐ąĮąĖčģ ą╝ąŠąĮąŠą╝ąĄčĆč¢ą▓: ą┤ąĖą▓č¢ąĮč¢ą╗čā, č¢ąĘąŠą┐čĆąĄąĮčā, čģą╗ąŠčĆąŠą┐čĆąĄąĮčā, ąŠą╗ąĄčäč¢ąĮč¢ą▓, ąĄč鹥ąĮčā + ą┐čĆąŠą┐ąĄąĮčā č¢ ąĖąĘąŠą▒čāč鹥ąĮčā.
ą©ąĖąĮąĮąĖą╣ ą║ą░čāčćčāą║ ąŠą┤ąĄčĆąČčāčÄčéčī čüąŠą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čöčÄ ą▒čāčéą░ą┤č¢čöąĮčā ąĘč¢ čüčéąĖčĆąĄąĮąŠą╝. ąÜą░čāčćčāą║ąĖ čüčéč¢ą╣ą║č¢ ą┤ąŠ ą┤č¢čŚ ą▒ąĄąĮąĘąĖąĮčā č¢ ą╝ą░čüąĄą╗ ąŠčéčĆąĖą╝čāčÄčéčī čüąŠą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čöčÄ ą▒čāčéą░ą┤č¢čöąĮčā ąĘ ą░ą║čĆąĖą╗ąŠąĮč¢čéčĆąĖą╗ąŠą╝. ąźč¢ą╝č¢čćąĮąŠ čüčéč¢ą╣ą║ąĖą╣ ą▒čāčéąĖą╗ą║ą░čāčćčāą║ ąŠčéčĆąĖą╝čāčÄčéčī čüąŠą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čöčÄ č¢ąĘąŠą▒čāč鹥ąĮčā ąĘ ą┤ąĖą▓č¢ąĮč¢ą╗ąŠą╝ ą░ą▒ąŠ č¢ąĘąŠą┐čĆąĄąĮčā.
ąÜą░čāčćčāą║ čÅą▓ą╗čÅčö čüąŠą▒ąŠčÄ ą┐ą╗ą░čüčéąĖčćąĮąĖą╣ ą╝ą░č鹥čĆč¢ą░ą╗. ąöą╗čÅ č鹊ą│ąŠ čēąŠą▒ ąĮą░ą┤ą░čéąĖ ą╣ąŠą╝čā ą╝č¢čåąĮč¢čüčéčī, ąĘąĮąŠčüąŠčüčéč¢ą╣ą║č¢čüčéčī, ąĄą╗ą░čüčéąĖčćąĮč¢čüčéčī, čüčéč¢ą╣ą║č¢čüčéčī ą┤ąŠ ąĘą╝č¢ąĮ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ, ą┤ąŠ ą┤č¢čŚ čĆąŠąĘčćąĖąĮąĮąĖą║č¢ą▓ č¢ čģč¢ą╝č¢čćąĮąĖčģ čĆąĄą░ą│ąĄąĮčéč¢ą▓, ą║ą░čāčćčāą║ ą┐č¢ą┤ą┤ą░čÄčéčī ą▓čāą╗ą║ą░ąĮč¢ąĘą░čåč¢čŚ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮčÅą╝ ąĘ čüč¢čĆą║ąŠčÄ ą░ą▒ąŠ čüą┐ąŠą╗čāą║ą░ą╝ąĖ čüčāą╗čīčäčāčĆčā (ą▓čāą╗ą║ą░ąĮč¢ąĘą░č鹊čĆ) ą▓ čüčāą╝č¢čłč¢ ąĘ ąĮą░ą┐ąŠą▓ąĮčÄą▓ą░čćą░ą╝ąĖ (čüą░ąČą░, čüąĖą╗č¢čåč¢ą╣ ą┤č¢ąŠą║čüąĖą┤, čüąĖą╗č¢čåč¢čöą▓č¢ ą║ąĖčüą╗ąŠčéąĖ č¢ č¢ąĮ. ). ąÆ ą┐čĆąŠčåąĄčüč¢ ą▓čāą╗ą║ą░ąĮč¢ąĘą░čåč¢čŚ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ “ąĘčłąĖą▓ą░ąĮąĮčÅ” ą╗č¢ąĮč¢ą╣ąĮąĖčģ ą╝ąŠą╗ąĄą║čāą╗ ą║ą░čāčćčāą║čā ą▓ čēąĄ ą▒č¢ą╗čīčłč¢ čüč¢čéčćą░čüčéč¢ (čéčĆąĖą▓ąĖą╝č¢čĆąĮč¢) ą╝ąŠą╗ąĄą║čāą╗ąĖ: ą▓ąĖčģąŠą┤ąĖčéčī ą│čāą╝ą░.
ąĀč¢ąĘąĮč¢ ą▓ąĖą┤ąĖ čüąĖąĮč鹥čéąĖčćąĮąŠą│ąŠ č¢ ąĮą░čéčāčĆą░ą╗čīąĮąŠą│ąŠ ą║ą░čāčćčāą║čā čłąĖčĆąŠą║ąŠ ąĘą░čüč鹊čüąŠą▓čāčÄčéčīčüčÅ ą▓ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąŠčüčéč¢ čéčĆą░ąĮčüą┐ąŠčĆčéąĮąĖčģ ąĘą░čüąŠą▒č¢ą▓, ą╝ą░čłąĖąĮąŠą▒čāą┤čāą▓ą░ąĮąĮč¢, ąĄą╗ąĄą║čéčĆąŠč鹥čģąĮč¢čåč¢, ą▓ąĘčāčéčéčöą▓ąŠčŚ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąŠčüčéč¢ č¢ čé.ą┤.










