Алкадиены (диены, диеновые углеводороды) CnH2n-2
Алкадиены – это углеводороды, которые в составе молекулы имеют две двойные связи между атомами углерода.
Поскольку для образования двух двойных связей необходимо по крайней мере три атома углерода, в этом ряду гомологи с одним и двумя атомами углерода не существуют.
Алкадиены в природе
В природе алкадиены встречаются в млечном соке некоторых растений (Гевея).
Изомерия алкадиенов
Алкадиены, так же как и алкены, имеют изомерию углеродного скелета и цис-транс-изомерию.
В зависимости от взаимного расположения двойных связей диеновые углеводороды можно разделить на три основных типа:
- Углеводороды с кумулированными (примыкающими к одному атому углерода) двойными связями – аллен и его гомологи;
- Углеводороды с сопряженными (конъюгированными) двойными связями – дивинил и его гомологи;
- Углеводороды с изолированными двойными связями.
Диеновые углеводороды первых двух типов проявляют своеобразные свойства. Для углеводородов третьего типа характерны обычные реакции этиленовых углеводородов, только в них принимают участие не одна, а обе связи с большей или меньшей селективностью.
Номенклатура алкадиенов
Диеновые углеводороды по систематической номенклатуре называются так же, как и этиленовые углеводороды, только вместо суффикса -ен ставится суффикс -адиен (так как двойных связей две). Положение двойных связей, как обычно, показывают цифрами. Для некоторых диенов сохранились тривиальные или старые рациональные названия:
пропадиен, аллен
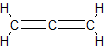
1,2-бутадиен, метилаллен
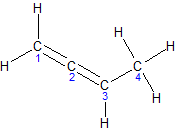
1,3-бутадиен, дивинил

2-метил-1,3-бутадиен, изопрен
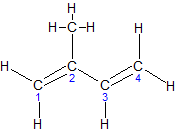
1,3-пентадиен, пиперилен
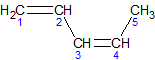
2,3-диметил-1,3-бутадиен
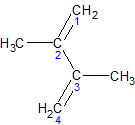
Особенности строения алкадиенов
В молекуле алкадиена с кумулированными связями π-связи располагаются в двух взаимно перпендикулярных плоскостях. Плоскости, в которых располагаются две пары водородных атомов, также взаимно перпендикулярны. Два крайних углеродных атома кумулированной системы находятся в состоянии sр2-гибридизации, средний углеродный атом в sp-гибридизации.
Эти особенности квантово-механического строения проявляются в физических и химических свойствах диенов. В частности, в ряду диенов при двух различных заместителях у конечных углеродных атомов возможна оптическая активность благодаря молекулярнои асимметии. Два пространственных изомера, относящихся друг к другу как предмет к своему зеркальному изображению, при наложении не совпадают, следовательно, представляют собой две различные изомерные молекулы.
Для диенов характерны легкость гидратации разбавленной серной кислотой с образованием кетонов, способность полимеризоваться или конденсироваться с другими непредельными соединениями с образованием четырехчленных циклов.
Получение алкадиенов
Способы получения 1,3-алкадиенов.
Способы получения углеводородов ряда дивинила в большинстве случаев не отличаются от способов получения олефинов, только соответствующие реакции необходимо проводить дважды или в качестве исходного вещества применять соединения, уже содержащие двойную связь.
1. Дивинил и изопрен получают в промышленности дегидрогенизацией соответственно бутано-бутиленовых или изопентан-амиленовых смесей обычно над катализаторами, содержащими Cr2O3:
H3C-CH2-CH2-CH3 → H3C-CH=CH-CH3 → H2C=CH-CH=CH2
H3C-CH(CH3)-CH2CH3 → H3C-C(CH3)=CH-CH3 → H2C=C(CH3)-CH=CH2
2. Дивинил, изопрен, диизопропенил (в промышленных масштабах) получают дегидратацией гликолей:
H3C-CHOH-CH2-CH2OH → H2C=CH-CH=CH2 + H2O
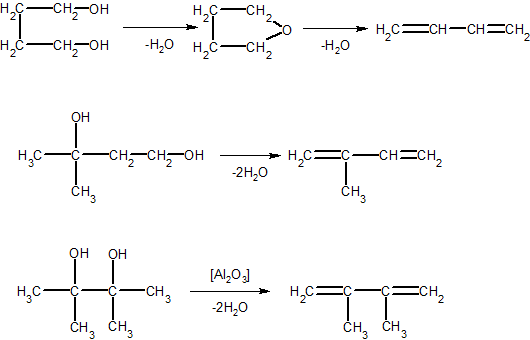
3. Алкадиены получают также дегидратацией непредельных спиртов, например, дивинил получают дегидратацией кротилового спирта:
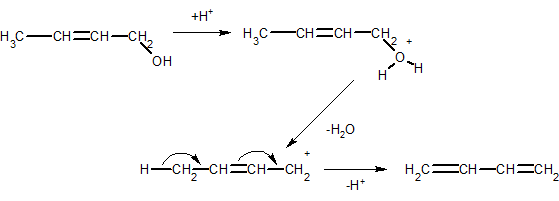
4. Пары этилового спирта пропускают над дегидрирующим и дегидратирующим катализаторами, в результате чего получается дивинил с выходом более 70% (от теоретического):
2H3C-CH2-OH → H2C=CH-CH-CH2 + 2H2O + H2
Физические свойства алкадиенов
Дивинил при обычных условиях – газ. Изопрен и другие простейшие алкадиены – жидкости. Обычные закономерности, свойственные гомологическим рядам углеводородов, действуют и в этом ряду.
Для алкадиенов с сопряженными двойными связями характерны аномально высокие показатели преломления света. Благодаря этой особенности найденные молекулярные рефракции алкадиенов значительно больше вычисленных. Разница между найденной и вычисленной величинами составляет обычно 1-1,5 единиц. Она называется молекулярная экзальтация.
Алкадиены поглощают ультрафиолетовое излучение в значительно более длинноволновой области, чем алкены. Например, 1,З-бутадиен поглощает при 217 нм. Накопление в молекуле сопряженных двойных связей ведет к дальнейшему смещению максимума поглощения из ультрафиолетовой области в видимую область: при четырех сопряженных двойных связях, появляется желтая окраска.
В ИК-спектрах для 1,3-алкадиенов характерно снижение частоты и увеличение интенсивности полосы валентных колебаний двойных связей (примерно до 1600 см-1).
Химические свойства алкадиенов
Химические свойства 1,3-алкадиенов.
Две сопряженные π-связи образуют общее электронное облако – все четыре углеродных атома находятся в состоянии sp2-гибридизации. Это приводит к укорочению простой связи (до 0,146 нм) и к стабилизации молекулы. Так, например, энергия образования молекулы дивинила на 14,6 кДж/моль больше по сравнению с вычисленной энергией образования углеводорода того же состава, но без учета сопряжения двойных связей. Эту разность называют энергия резонанса. Эта особенность в строении диеновых углеводородов делает их способными присоединять различные вещества не только по одной из двойных связей, но и к крайним атомам сопряженной системы в 1,4-положение с перемещением двойной связи.
Гидрирование алкадиенов. Каталитически возбужденный водород (Pt, Pd) присоединяется в 1,2- и 1,4-положения:
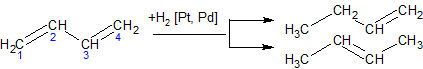
Галогенирование алкадиенов (присоединение галогенов). Галогены могут присоединяться к сопряженным системам в 1,2- и 1,4-положения, причем количество 1,4-продукта зависит от строения диенового углеводорода, природы галогена и условий проведения химической реакции. Выход продукта 1,4-присоединения возрастает при повышении температуры (в определенных пределах) при переходе от хлора к йоду:

Присоединение может происходить по ионному или по радикальному механизму.
При ионном механизме присоединения, например хлора, первоначально возникающий π-комплекс (I) быстро превращается в сопряженный карбений-хлорониевый ион с положительным зарядом на C2 и C4 атомах, который можно изобразить двумя граничными формулами (II) или одной мезомерной формулой (III). Этот ион присоединяет далее анион хлора в положения 2 и 4 с образованием продуктов 1,2- и 1,4-присоединения. Последние, в свою очередь, могут изомеризоваться в подходящих условиях один в другой до достижения состояния равновесия через тот же самый промежуточный карбениевый ион:
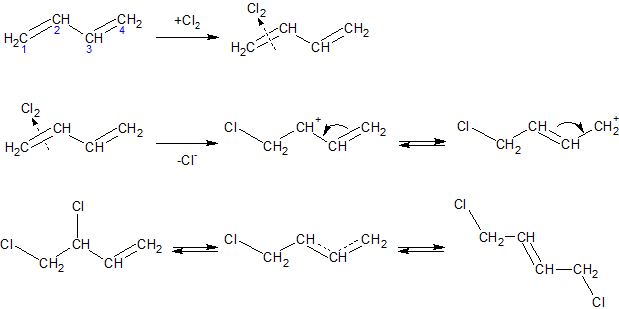
Если в условиях реакции присоединения система близка к состоянию равновесия, содержание каждого изомера в продуктах реакции зависит от
положения равновесия. Обычно 1,4-продукт энергетически более выгоден и потому преобладает.
Наоборот, когда система далека от состояния равновесия, может образоваться преимущественно 1,2-продукт, если энергия активации в реакции его образования ниже, чем в реакции образования 1,4-продукта. Так, в случае присоединения хлора к дивинилу получается примерно равное количество 1,2- и 1,4-дихлорбутенов, в случае же присоединения брома получается около 66% 1,4-продукта, так как связь C-Br менее прочна, чем связь C-Cl, и равновесие для бромида достигается легче. Повышение температуры приближает систему к равновесному состоянию.
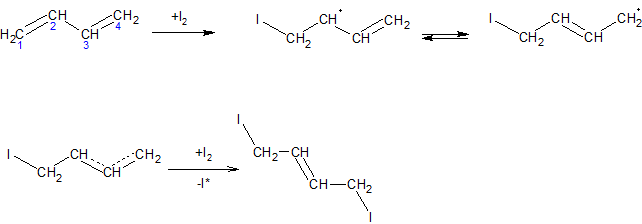
При радикальном присоединении атома галогена образуется сопряженный радикал, который также обладает двойственной реакционной способностью, однако образуется преимущественно 1,4-аддукт:
Электрофильное присоединение хлора к бутадиену в рамках теории молекулярных орбиталей может быть описано следующим образом.
Молекула бутадиена имеет две π-связи, следовательно, четыре молекулярные π-орбитали (две связывающие и две разрыхляющие).
Наличие орбитали с низкой энергией ψ1 и перекрыванием всех четырех π-орбиталей объясняет ее повышенную устойчивость.
При столкновении молекулы бутадиена с молекулой хлора высшая занятая молекулярная орбиталь бутадиена ψ2 перекрывается со свободной атомной орбиталью Cl+ с образованием молекулярных орбиталей связи C-Cl и освобождением Cl–. В результате возникает карбениевый ион аллильного типа с двумя электронами на трех π-орбиталях, одна из которых (ψ2) имеет на втором атоме углерода узел.
Этот ион далее взаимодействует с ионом хлора: высшая занятая орбиталь этого иона перекрывается с низшей вакантной орбиталью аллильного иона. При этом новая связь C-Cl может образовываться либо с атомом C1, либо с атомом C2.
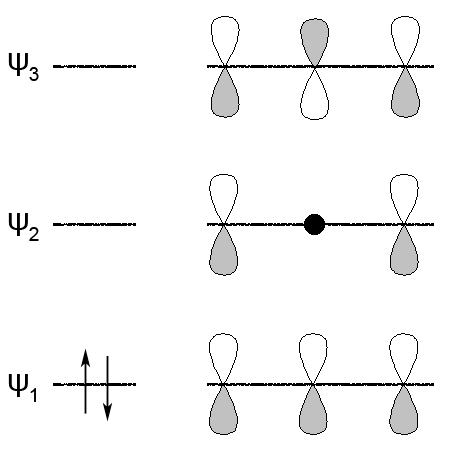
Гидрогалогенирование диенов. В реакциях присоединения галогеноводородов действуют те же закономерности:

Гипогалогенирование диенов. Гипогалогенные кислоты и их эфиры присоединяются преимущественно в 1,2-положения. Здесь система в момент реакции особенно далека от состояния равновесия (связь C-O значительно прочнее связей C-Hlg), а энергия активации в реакции образования 1,2- продукта ниже, чем в реакции образования 1,4-продукта:
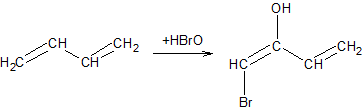
Димеризация диенов. При нагревании молекулы диеновых углеводородов способны присоединяться друг к другу таким образом, что одна из них реагирует в 1,2-, а другая в 1,4-положениях. Одновременно в небольших количествах получается также продукт присоединения обеих молекул в 1,4-положение:

В такую реакцию димеризации могут вступать и молекулы различных диенов:
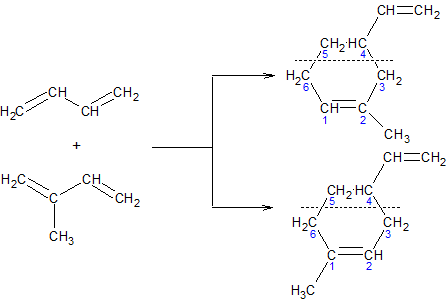
Диеновый синтез. Особенно легко реакции димеризации алкадиенов идут в том случае, когда одна из реагирующих молекул имеет активированную двойную связь, электрофильность которой повышена благодаря сопряжению с электроотрицательными атомами. Подобные конденсации получили название Диеновый синтез или реакция Дильса-Альдера:
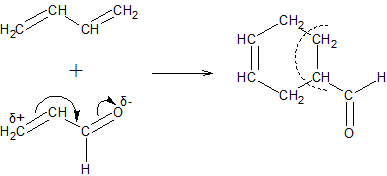
Эта реакция широко используется для качественного и количественного определения диеновых углеводородов, а также для синтеза различных соединений с шестичленными циклами.
Реакции диенового синтеза и димеризации алкадиенов идут через циклическое переходное состояние с одновременным или почти одновременным образованием обеих новых связей, т.е. как перециклические процессы.
Возможность и условия протекания подобного рода реакций циклизации, проходящих без промежуточного образования радикалов или ионов, подчиняются закономерностям под названием правила Вудворта-Гофмана. Согласно правилам Вудворта-Гофмана, для того чтобы замкнулся цикл, орбитали, образующие новые связи, должны иметь возможность перекрыться с образованием связывающих орбиталей, т.е. должны быть направлены друг к другу сегментами одинакового знака.
Если для этого не требуется возбуждение какой-либо из реагирующих молекул (переход электронов на более высокий уровень с изменением знака сегментов), то процесс разрешен по симметрии как термический процесс, т.е. реакция будет идти или ускоряться при нагревании. Если для указанной выше ориентации орбиталей необходимо перевести электроны одной из молекул на более высокий уровень (на разрыхляющую орбиталь), реакция разрешена по симметрии только как фотохимический процесс.
Реакции диенового синтеза протекают как термический процесс.
В противоположность диеновому синтезу замыкание двух молекул алкена в четырехчленный цикл не происходит как термический процесс, для осуществления такой реакции необходимо возбуждение молекул с помощью ультрафиолетового излучения.
Реакции диенового синтеза могут идти также и по радикальному и по каталитическому механизмам с образованием промежуточных частиц. К реакциям диенового синтеза, которые идут по радикальному или по каталитическому механизму, правила Вудворта-Гофмана отношения не имеют.
Теломеризация диенов. Известны реакции теломеризации алкадиенов с галогенопроизводными, водой, спиртами, кислотами, аминами и др., например:
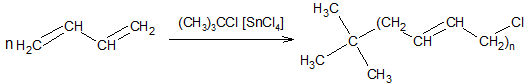
Реакции теломеризации используются в многостадийном синтезе алифатических и моноциклических терпенов.
Полимеризация диенов. Важной особенностью диеновых углеводородов с сопряженными связями является способность их полимеризоваться в каучукоподобные продукты.
Скорость полимеризации зависит от строения диенов и внешних условий. Замещение в середине молекулы облегчает, а на конце молекулы, затрудняет полимеризацию: изопрен полимеризуется быстрее, пиперилен медленнее, чем дивинил. При нагревании и под давлением полимеризация ускоряется.
Промышленный интерес представляет цепная полимеризация диеновых углеводородов под влиянием катализаторов или инициаторов. В качестве катализаторов используются щелочные металлы, металлоорганические соединения, в качестве инициаторов – органические и неорганические пероксиды.
При полимеризации отдельные молекулы мономеров могут соединяться друг с другом в 1,2-, в 1,4-положении или одна молекула реагирует в 1,2-, а другая в 1,4-положении:
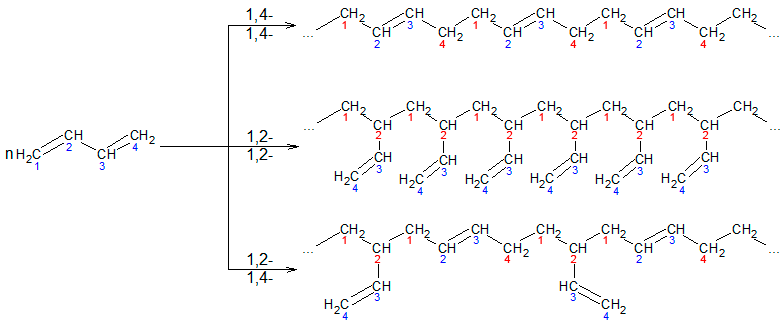
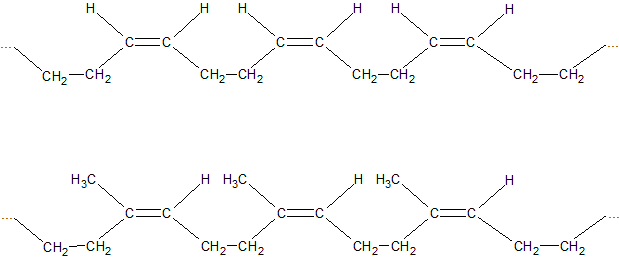
Стереорегулярная полимеризация (пространственно упорядоченная полимеризация) в 1,4-положении с образованием цис-конфигурации каждого остатка, дает полимеры с наиболее ценными свойствами. Стереорегулярная полимеризация идет на катализаторах, приготовленных на основе металлорганических соединений, например алюминий- или литийорганических (К. Циглер, Дж. Натта):
Также, диеновые углеводороды вступают в реакцию сополимеризации с другими мономерами – стирол, акрилонитрил и др.
Применение алкадиенов.
Натуральный и синтетический каучуки.
Натуральный каучук добывается из сока некоторых растений. К каучуковым растениям относятся гевея, гваюлла, кок-сагыз, тау-сагыз, обыкновенный одуванчик. Промышленное значение имеет в настоящее время получение натурального каучука только на основе культивированных плантаций тропического дерева гевея.
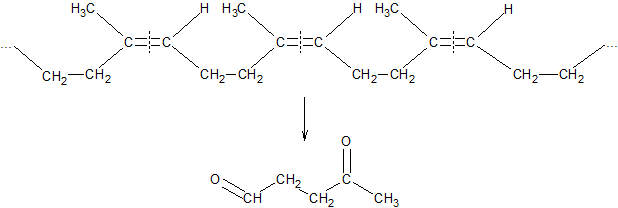
По химическому составу и строению натуральный каучук представляет собой стереорегулярный цис-полимер изопрена. Транс-полимер изопрена встречается в природе под названием гуттаперча.
Строение каучука было доказано методом озонирования (Гарриес). Получение при озонолизе левулинового альдегида подтверждает упорядоченное 1,4-строение:
Немногие страны имеют возможность производить натуральный каучук. В основном природный каучук заменяют синтетическим. Синтетические каучуки производят на основе следующих мономеров: дивинила, изопрена, хлоропрена, олефинов, этилена + пропилена и изобутилена.
Шинный каучук получают сополимеризацией бутадиена со стиролом. Каучуки устойчивые к действию бензина и масел получают сополимеризацией бутадиена с акрилонитрилом. Химически стойкий бутилкаучук получают сополимеризацией изобутилена с дивинилом или изопреном.
Каучук представляет собой пластичный материал. Для того чтобы придать ему прочность, износоустойчивость, эластичность, стойкость к изменениям температуры, к действию растворителей и химических реагентов, каучук подвергают вулканизации нагреванием с серой или ее соединениями (вулканизатор) в смеси с наполнителями (сажа, диоксид кремния, кремниевые кислоты и др.). В процессе вулканизации происходит “сшивание” линейных молекул каучука в еще более крупные сетчатые (трехмерные) молекулы: получается резина.
Различные виды синтетического и натурального каучука широко применяются в промышленности транспортных средств, машиностроении, электротехнике, обувной промышленности и т.д.










