ąĢčüą╗ąĖ ą┤ą▓ą░ čĆą░ąĘąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ą░ ą┐ąŠą│čĆčāąĘąĖčéčī ą▓ čĆą░čüčéą▓ąŠčĆ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░, č鹊 ą╝ąĄąČą┤čā ąĮąĖą╝ąĖ ą▓ąŠąĘąĮąĖą║ą░ąĄčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠąĄ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ (čĆą░ąĘąĮąŠčüčéčī ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą▓). ąóą░ą║čāčÄ čüąĖčüč鹥ą╝čā ąĮą░ąĘčŗą▓ą░čÄčé ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé, ąĖą╗ąĖ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ą░čÅ čåąĄą┐čī.
ą£ąĄčéą░ą╗ą╗ 1 | ąĀą░čüčéą▓ąŠčĆ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░ | ą£ąĄčéą░ą╗ą╗ 2
ąÆą╝ąĄčüč鹊 ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą▓ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą╣ čåąĄą┐ąĖ ą╝ąŠąČąĮąŠ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī ąĖ ą┤čĆčāą│ąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░ čü ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčīčÄ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą│čĆą░čäąĖčé (čāą│ąŠą╗čīąĮčŗą╣ 菹╗ąĄą║čéčĆąŠą┤).
ąĀą░ąĘąĮąŠčüčéčī ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą▓, ą▓ąŠąĘąĮąĖą║ą░čÄčēą░čÅ ą╝ąĄąČą┤čā ą┤ą▓čāą╝čÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖą╝ąĖ 菹╗ąĄą║čéčĆąŠą┤ą░ą╝ąĖ ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ čĆą░ąĘąĮąŠą╣ čüą║ą╗ąŠąĮąĮąŠčüčéčīčÄ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąŠčéą┤ą░ą▓ą░čéčī ą║ą░čéąĖąŠąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░. ąØą░ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ ą║ą░ąČą┤ąŠą│ąŠ ąĖąĘ 菹╗ąĄą║čéčĆąŠą┤ąŠą▓ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ą┤ą▓ąŠą╣ąĮąŠą╣ 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąĖą╣ čüą╗ąŠą╣, ą║ąŠč鹊čĆčŗą╣ ą┐čĆąĄą┐čÅčéčüčéą▓čāąĄčé ą┤ą░ą╗čīąĮąĄą╣čłąĄą╝čā ą┐ąĄčĆąĄčģąŠą┤čā ą║ą░čéąĖąŠąĮąŠą▓ ą▓ čĆą░čüčéą▓ąŠčĆ. ąĢčüą╗ąĖ ąŠą▒ą░ ą╝ąĄčéą░ą╗ą╗ą░ čüąŠąĄą┤ąĖąĮąĖčéčī ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖą╝ 菹╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą╝, ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ 菹╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéąĖ čĆą░čüčéą▓ąŠčĆą░ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ (ąĖąŠąĮąĮą░čÅ čŹą╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéčī) ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ąĘą░ą╝ą║ąĮčāčéą░čÅ čŹą╗ąĄą║čéčĆąĖč湥čüą║ą░čÅ čåąĄą┐čī.
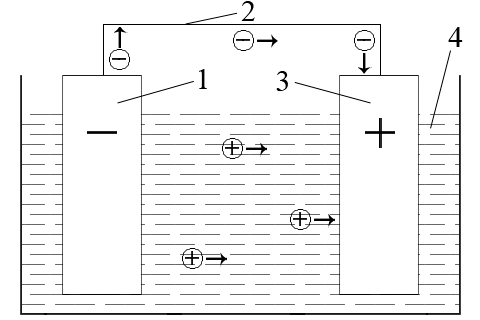
ąÆ čŹč鹊ą╣ čåąĄą┐ąĖ ą┐ąŠč鹊ą║ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▒čāą┤ąĄčé ą┐ąĄčĆąĄą╝ąĄčēą░čéčīčüčÅ ąŠčé ą╝ąĄąĮąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░ č湥čĆąĄąĘ ą▓ąĮąĄčłąĮčÄčÄ čćą░čüčéčī čåąĄą┐ąĖ (ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖą╣ ą┐čĆąŠą▓ąŠą┤ąĮąĖą║) ą║ ą▒ąŠą╗ąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą╝čā ą╝ąĄčéą░ą╗ą╗čā. ą¤čĆąĖ čŹč鹊ą╝ ą▓ čĆą░čüčéą▓ąŠčĆąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ ą║ą░čéąĖąŠąĮčŗ ą▒čāą┤čāčé ą┤ą▓ąĖą│ą░čéčīčüčÅ ą║ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą╝čā ą╝ąĄčéą░ą╗ą╗čā ąĖ čĆą░ąĘčĆčÅąČą░čéčīčüčÅ ą┐ąŠą┤ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ ąĖą╝ąĄčÄčēąĖčģčüčÅ ą▓ ąĮąĄą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓. ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 ą▓ ąĘą░ą╝ą║ąĮčāč鹊ą╣ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą╣ čåąĄą┐ąĖ ą▓ąŠąĘąĮąĖą║ąĮąĄčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║.
ąŁą╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąĖąĄ ą┐čĆąŠčåąĄčüčüčŗ, ą╗ąĄąČą░čēąĖčģ ą▓ ąŠčüąĮąŠą▓ąĄ čäčāąĮą║čåąĖąŠąĮąĖčĆąŠą▓ą░ąĮąĖčÅ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓, čüčģąĄą╝ą░čéąĖčćąĮąŠ ą╝ąŠąČąĮąŠ ą┐čĆąĄą┤čüčéą░ą▓ąĖčéčī čéą░ą║:
ąÉąĮąŠą┤ (-): ąØąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗą╣ ą╝ąĄčéą░ą╗ą╗; ą×ą║ąĖčüą╗ąĄąĮąĖąĄ (ąŠčéą┤ą░čćą░ 菹╗ąĄą║čéčĆąŠąĮąŠą▓, ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą║ą░čéąĖąŠąĮąŠą▓).
ąÜą░č鹊ą┤ (+): ąæą╗ą░ą│ąŠčĆąŠą┤ąĮčŗą╣ ą╝ąĄčéą░ą╗ą╗; ąÆąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ (ą┐čĆąĖąĄą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓, čĆą░ąĘčĆčÅą┤ ą║ą░čéąĖąŠąĮąŠą▓).
ą¤čĆąĖą╝ąĄčĆ.
ąōą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé ąöą░ąĮąĖ菹╗čÅ-ą»ą║ąŠą▒ąĖ čüąŠčüč鹊ąĖčé ąĖąĘ čåąĖąĮą║ąŠą▓ąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą┤ą░ – čåąĖąĮą║ąŠą▓ą░čÅ ą┐ą╗ą░čüčéąĖąĮą░, ą┐ąŠą│čĆčāąČąĄąĮąĮą░čÅ ą▓ čĆą░čüčéą▓ąŠčĆ čüčāą╗čīčäą░čéą░ čåąĖąĮą║ą░(II), ąĖ ą╝ąĄą┤ąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą┤ą░ – ą╝ąĄą┤ąĮą░čÅ ą┐ą╗ą░čüčéąĖąĮą░, ą┐ąŠą│čĆčāąČąĄąĮąĮą░čÅ ą▓ čĆą░čüčéą▓ąŠčĆ čüčāą╗čīčäą░čéą░ ą╝ąĄą┤ąĖ(II):
Zn | ZnSO4 || CuSO4 | Cu
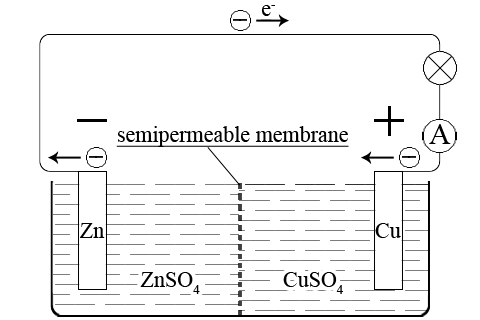
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą┤ą░ąĮąĮčŗą╣ 菹╗ąĄą╝ąĄąĮčé ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║čāčÄ čüąĖčüč鹥ą╝čā:
ą£ąĄčéą░ą╗ą╗ 1 | ąĀą░čüčéą▓ąŠčĆ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░ 1 || ąĀą░čüčéą▓ąŠčĆ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░ 2 | ą£ąĄčéą░ą╗ą╗ 2
ąÆ čŹč鹊ą╝ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą╝ 菹╗ąĄą╝ąĄąĮč鹥 ą┐čĆąŠč鹥ą║ą░čÄčé čüą╗ąĄą┤čāčÄčēąĖąĄ 菹╗ąĄą║čéčĆąŠą┤ąĮčŗąĄ ą┐čĆąŠčåąĄčüčüčŗ:
ąÉąĮąŠą┤ (-): Zn0 – 2ąĄ– = Zn2+ (ąŠą║ąĖčüą╗ąĄąĮąĖąĄ)
ąÜą░č鹊ą┤ (+): Cu2+ + 2ąĄ– = Cu0 (ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ)
ąĪčāą╝ą╝ą░čĆąĮą░čÅ ąŠą║ąĖčüą╗ąĖč鹥ą╗čīąĮąŠ-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čīąĮą░čÅ čĆąĄą░ą║čåąĖčÅ
Zn0 + Cu2+ = Zn2+ + Cu0
ąÜą░ąČą┤čŗą╣ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé čüąŠčüč鹊ąĖčé ąĖąĘ ą┤ą▓čāčģ 菹╗ąĄą║čéčĆąŠą┤ąŠą▓ (ąŠą║ąĖčüą╗ąĖč鹥ą╗čīąĮąŠ-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čīąĮą░čÅ ą┐ą░čĆą░), ąŠą┤ąĖąĮ ąĖąĘ ą║ąŠč鹊čĆčŗčģ čÅą▓ą╗čÅąĄčéčüčÅ ą┤ąŠąĮąŠčĆąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓, ą░ ą▓č鹊čĆąŠą╣ ą░ą║čåąĄą┐č鹊čĆąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓. ą¤čĆąĖ čŹč鹊ą╝ ąĮą░ ąŠą┤ąĮąŠą╝ 菹╗ąĄą║čéčĆąŠą┤ąĄ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ąĖąĘą▒čŗč鹊ą║ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ (čåąĖąĮą║), ą░ ąĮą░ ą▓č鹊čĆąŠą╝ ąĮąĄą┤ąŠčüčéą░č鹊ą║ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ (ą╝ąĄą┤čī).
ąŁą╗ąĄą║čéčĆąŠą┤ čü ąĖąĘą▒čŗčéą║ąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ąĘčŗą▓ą░čÄčé ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░, ąĖą╗ąĖ ą░ąĮąŠą┤ąŠą╝
ąŁą╗ąĄą║čéčĆąŠą┤ čü ąĮąĄą┤ąŠčüčéą░čéą║ąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓-ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝, ąĖą╗ąĖ ą║ą░č鹊ą┤ąŠą╝
ą×čéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ čüčéą░ąĮąŠą▓ąĖčéčüčÅ ą╝ąĄąĮąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗą╣ ą╝ąĄčéą░ą╗ą╗, ąĮą░ ą║ąŠč鹊čĆąŠą╝ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ąĖąĘą▒čŗč鹊ą║ 菹╗ąĄą║čéčĆąŠąĮąŠą▓.
ą¤ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ čüčéą░ąĮąŠą▓ąĖčéčüčÅ ą▒ąŠą╗ąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗą╣ ą╝ąĄčéą░ą╗ą╗, ąĮą░ ą║ąŠč鹊čĆąŠą╝ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ąĮąĄą┤ąŠčüčéą░č鹊ą║ 菹╗ąĄą║čéčĆąŠąĮąŠą▓.
ąŁą╗ąĄą║čéčĆąŠąĮčŗ ą┐ąŠ ą▓ąĮąĄčłąĮąĄą╝čā čāčćą░čüčéą║čā čåąĄą┐ąĖ, č鹊 ąĄčüčéčī ą┐ąŠ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╝čā ą┐čĆąŠą▓ąŠą┤ąĮąĖą║čā ą┐ąĄčĆąĄčģąŠą┤čÅčé ąŠčé ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠą│ąŠ ą║ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠą╝čā ą┐ąŠą╗čÄčüčā ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░.
ąØą░ą┐čĆąĖą╝ąĄčĆ.
ąÆ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą╝ 菹╗ąĄą╝ąĄąĮč鹥 čü čåąĖąĮą║ąŠą▓čŗą╝ ąĖ čüą▓ąĖąĮčåąŠą▓čŗą╝ 菹╗ąĄą║čéčĆąŠą┤ą░ą╝ąĖ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ ą▒čāą┤ąĄčé čåąĖąĮą║ (ąĢ0 = -0,763 ąÆ), ą░ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ čüą▓ąĖąĮąĄčå (E0 = -0,126 ąÆ). ąĪčéą░ąĮą┤ą░čĆčéąĮčŗą╣ ą┐ąŠč鹥ąĮčåąĖą░ą╗ čüą▓ąĖąĮčåą░ ą▒ąŠą╗ąĄąĄ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ č湥ą╝ čåąĖąĮą║ą░.
ąØą░ą┐čĆčÅąČąĄąĮąĖąĄ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ č鹥ą╝ ą▓čŗčłąĄ, č湥ą╝ ą▒ąŠą╗čīčłąĄ ąŠčéą╗ąĖčćą░čÄčéčüčÅ ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣ ąĘąĮą░č湥ąĮąĖčÅ čüčéą░ąĮą┤ą░čĆčéąĮąŠą│ąŠ ą┐ąŠč鹥ąĮčåąĖą░ą╗ą░ 菹╗ąĄą║čéčĆąŠą┤ąŠą▓.
ąØą░ą┐čĆčÅąČąĄąĮąĖąĄ, ą║ąŠč鹊čĆąŠąĄ ą┐ąŠą║ą░ąĘčŗą▓ą░ąĄčé ą▓ąŠą╗čīčéą╝ąĄčéčĆ, ą┐ąŠą┤ą║ą╗čÄč湥ąĮąĮčŗą╣ ą║ ą┐ąŠą╗čÄčüą░ą╝ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░, ąĮą░ąĘčŗą▓ą░čÄčé ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ ąĮą░ ą║ą╗ąĄą╝ą╝ą░čģ. ąŁč鹊 ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ąĮą░ą╗ąĖčćąĖčÅ ą▓ąĮčāčéčĆąĄąĮąĮąĄą│ąŠ čüąŠą┐čĆąŠčéąĖą▓ą╗ąĄąĮąĖčÅ ąĖčüč鹊čćąĮąĖą║ą░ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ ą╝ąĄąĮčīčłąĄ ąĖčüčéąĖąĮąĮąŠą│ąŠ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ, ą║ąŠč鹊čĆąŠąĄ ąĮą░ąĘčŗą▓ą░čÄčé 菹╗ąĄą║čéčĆąŠą┤ą▓ąĖąČčāčēąĄą╣ čüąĖą╗ąŠą╣, čüąŠą║čĆą░čēąĄąĮąĮąŠ čŹ.ą┤.čü (ąŠą▒ąŠąĘąĮą░čćą░ąĄčéčüčÅ ą║ą░ą║ E čŹ.ą┤.čü.). ąŁą╗ąĄą║čéčĆąŠą┤ą▓ąĖąČčāčēą░čÅ čüąĖą╗ą░ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ ą╝ąŠąČąĄčé ą▒čŗčéčī čĆą░čüčüčćąĖčéą░ąĮą░, ąĖčüčģąŠą┤čÅ ąĖąĘ ąĘąĮą░č湥ąĮąĖčÅ čüčéą░ąĮą┤ą░čĆčéąĮčŗčģ ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą▓ ąŠą▒ąĄąĖčģ ą┐ą░čĆ ą£n+/M0, ąĮąŠ ą╝ąŠąČąĄčé ą▒čŗčéčī ąĖ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮą░ čü ą┐ąŠą╝ąŠčēčīčÄ ą║ąŠą╝ą┐ąĄąĮčüą░čåąĖąŠąĮąĮąŠą╣ ąĖąĘą╝ąĄčĆąĖč鹥ą╗čīąĮąŠą╣ čüčģąĄą╝čŗ ąĖą╗ąĖ čü ą┐ąŠą╝ąŠčēčīčÄ ą▓ąŠą╗čīčéą╝ąĄčéčĆą░ čü ą▒ąĄčüą║ąŠąĮąĄčćąĮąŠ ą▒ąŠą╗čīčłąĖą╝ ą▓čģąŠą┤ąĮčŗą╝ čüąŠą┐čĆąŠčéąĖą▓ą╗ąĄąĮąĖąĄą╝.
ą¤čĆąĖ čüčéą░ąĮą┤ą░čĆčéąĮčŗčģ čāčüą╗ąŠą▓ąĖčÅčģ (25*ąĪ, 101,325 ą║ą¤ą░, ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ ą║ą░ąČą┤ąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ 1 ą╝ąŠą╗čī/ą┤ą╝3) ąĖčüčéąĖąĮąĮąŠąĄ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ čĆą░ą▓ąĮąŠ čĆą░ąĘąĮąŠčüčéąĖ ą╝ąĄąČą┤čā čüčéą░ąĮą┤ą░čĆčéąĮčŗą╝ ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą╝ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠą│ąŠ ą┐ąŠą╗čÄčüą░ ąĖ čüčéą░ąĮą┤ą░čĆčéąĮčŗą╝ ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą╝ ąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ą┐ąŠą╗čÄčüą░, č鹊 ąĄčüčéčī
E ąĄ.čĆ.čü. = E0 ą┐ąŠąĘ. ą┐ – ąĢ0 ąĮąĄą│. ą┐
ąŚąĮą░č湥ąĮąĖąĄ EąĄ.čĆ.čü. ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ čĆą░ą▓ąĮą░ čĆą░ąĘąĮąŠčüčéąĖ čüčéą░ąĮą┤ą░čĆčéąĮčŗčģ ą┐ąŠč鹥ąĮčåąĖą░ą╗ąŠą▓ ą▒ąŠą╗ąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ąĖ ą╝ąĄąĮąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░.
ą¤čĆąĖą╝ąĄčĆ.
ąśčüčéąĖąĮąĮąŠąĄ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ ąöą░ąĮąĖ菹╗čÅ-ą»ą║ąŠą▒ąĖ čĆą░ą▓ąĮąŠ
E ąĄ.čĆ.čü. = E0Cu – E0Zn = +0,338 – (-0,763) = 1,101 ąÆ
ąŚąĮą░čćąĖč鹥ą╗čīąĮąŠ ą▒ąŠą╗ąĄąĄ ą▓čŗčüąŠą║ąŠąĄ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ ąĖą╝ąĄąĄčé ą╗ąĖčéąĖąĄą▓ąŠą╝ąĄą┤ąĮčŗą╣ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé:
E ąĄ.čĆ.čü. = E0Cu – E0Li = +0,338 – (-3,045) = 3,383 ąÆ
ą£ą░ą╗ąŠą│ą░ą▒ą░čĆąĖčéąĮčŗąĄ ą╗ąĖčéąĖąĄą▓čŗąĄ 菹╗ąĄą╝ąĄąĮčéčŗ čłąĖčĆąŠą║ąŠ ąĖčüą┐ąŠą╗čīąĘčāčÄčéčüčÅ ą▓ ą║ą░č湥čüčéą▓ąĄ ąĖčüč鹊čćąĮąĖą║ąŠą▓ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ ą╝ąĖą║čĆąŠą║ą░ą╗čīą║čāą╗čÅč鹊čĆąŠą▓, 菹╗ąĄą║čéčĆąŠąĮąĮčŗčģ ąĮą░čĆčāčćąĮčŗčģ čćą░čüąŠą▓ ąĖ ą┤čĆčāą│ąĖčģ 菹╗ąĄą║čéčĆąŠąĮąĮčŗčģ čāčüčéčĆąŠą╣čüčéą▓.
ą¤ąŠ ą╝ąĄčĆąĄ ą┐čĆąŠčģąŠąČą┤ąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ č湥čĆąĄąĘ ąĘą░ą╝ą║ąĮčāčéčŗą╣ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé 菹╗ąĄą║čéčĆąŠą┤ ąĖąĘ ą╝ąĄąĮąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░ čĆą░ąĘčĆčāčłą░ąĄčéčüčÅ, ą╝ąĄčéą░ą╗ą╗ ą┐ąŠčüč鹥ą┐ąĄąĮąĮąŠ ą┐ąĄčĆąĄčģąŠą┤ąĖčé ą▓ čĆą░čüčéą▓ąŠčĆ ą▓ č乊čĆą╝ąĄ ąĖąŠąĮąŠą▓ (菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ą░čÅ ą║ąŠčĆčĆąŠąĘąĖčÅ). ą¤ąŠ čŹč鹊ą╣ ą┐čĆąĖčćąĖąĮąĄ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ ąĖą╝ąĄčÄčé ą▓ąĄčüčīą╝ą░ ąŠą│čĆą░ąĮąĖč湥ąĮąĮčŗą╣ čüčĆąŠą║ čüą╗čāąČą▒čŗ.
ąöąĄą╣čüčéą▓ąĖąĄ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓ ą║ą░ą║ ąĖčüč鹊čćąĮąĖą║ąŠą▓ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ ąŠčüąĮąŠą▓ą░ąĮąŠ ąĮą░ čģąĖą╝ąĖč湥čüą║ąŠą╣ ą┐čĆąĖčĆąŠą┤ąĄ 菹╗ąĄą║čéčĆąŠą┤ąŠą▓ ąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓.
ą¤ąĄčĆą▓ąĖčćąĮčŗąĄ ąĖčüč鹊čćąĮąĖą║ąĖ č鹊ą║ą░ – čŹč鹊 ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ.
ąÆč鹊čĆąĖčćąĮčŗąĄ ąĖčüč鹊čćąĮąĖą║ąĖ č鹊ą║ą░ – čŹč鹊 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖąĄ ą░ą║ą║čāą╝čāą╗čÅč鹊čĆčŗ.
ąŁą╗ąĄą║čéčĆąĖč湥čüą║ąĖąĄ ą░ą║ą║čāą╝čāą╗čÅč鹊čĆčŗ, ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓, ą╝ąŠąČąĮąŠ ąĘą░čĆčÅąČą░čéčī, ą┐ąŠą┤ą║ą╗čÄčćąĖą▓ ą║ ą▓ąĮąĄčłąĮąĄą╝čā ąĖčüč鹊čćąĮąĖą║čā 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░. ą¤ąŠčŹč鹊ą╝čā 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖąĄ ą░ą║ą║čāą╝čāą╗čÅč鹊čĆčŗ ąĖą╝ąĄčÄčé čüčāčēąĄčüčéą▓ąĄąĮąĮąŠ ą▒ąŠą╗čīčłąĖą╣ čüčĆąŠą║ 菹║čüą┐ą╗čāą░čéą░čåąĖąĖ.
ąØą░ąĖą▒ąŠą╗čīčłąĄąĄ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĖąĄ ą┐ąŠą╗čāčćąĖą╗ąĖ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ ąÆąŠą╗čīčéą░, ąöą░ąĮąĖ菹╗čÅ-ą»ą║ąŠą▒ąĖ ąĖ ąøąĄą║ą╗ą░ąĮčłąĄ.
ąōą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé ąÆąŠą╗čīčéą░ čüąŠčüč鹊ąĖčé ąĖąĘ ą╝ąĄą┤ąĮąŠą╣ ąĖ čåąĖąĮą║ąŠą▓ąŠą╣ ą┐ą╗ą░čüčéąĖąĮ, ą┐ąŠą│čĆčāąČąĄąĮąĮčŗčģ ą▓ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ. ąÆčüą╗ąĄą┤čüčéą▓ąĖąĄ ą▓čŗą┤ąĄą╗ąĄąĮąĖčÅ ąĮą░ ą╝ąĄą┤ąĮąŠą╝ 菹╗ąĄą║čéčĆąŠą┤ąĄ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ ą▓ąŠą┤ąŠčĆąŠą┤ą░ (ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ) 菹╗ąĄą╝ąĄąĮčé ąÆąŠą╗čīčéą░ ąĮąĄ ąŠą▒ą╗ą░ą┤ą░ąĄčé ą┐ąŠčüč鹊čÅąĮąĮčŗą╝ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄą╝. ąŁč鹊 ą▒čŗą╗ ąĖčüč鹊čĆąĖč湥čüą║ąĖ ą┐ąĄčĆą▓čŗą╣ čģąĖą╝ąĖč湥čüą║ąĖą╣ ąĖčüč鹊čćąĮąĖą║ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░, čüąŠąĘą┤ą░ąĮąĮčŗą╣ ąĖčéą░ą╗čīčÅąĮčüą║ąĖą╝ čäąĖąĘąĖą║ąŠą╝ ąÆąŠą╗čīčéą░ (1880 ą│ąŠą┤) ą▓ ą▓ąĖą┤ąĄ č湥čĆąĄą┤čāčÄčēąĖčģčüčÅ ą╝ąĄą┤ąĮčŗčģ ąĖ čåąĖąĮą║ąŠą▓čŗčģ ą┐ą╗ą░čüčéąĖąĮ, čĆą░ąĘą┤ąĄą╗ąĄąĮąĮčŗčģ ą┐ąŠą╗ąŠčüą║ą░ą╝ąĖ č乥čéčĆą░, čüą╝ąŠč湥ąĮąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆąŠą╝ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ.
ąōą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé ąöą░ąĮąĖ菹╗čÅ-ą»ą║ąŠą▒ąĖ čüąŠąĘą┤ą░ąĮ ą▓ 1836 ą│ąŠą┤čā ą░ąĮą│ą╗ąĖą╣čüą║ąĖą╝ čāč湥ąĮčŗą╝ ąöą░ąĮąĖ菹╗ąĄą╝ ąĖ čāčüąŠą▓ąĄčĆčłąĄąĮčüčéą▓ąŠą▓ą░ąĮ ą▓ 1938 ą│ąŠą┤čā čäąĖąĘąĖą║ąŠą╝ ąæ.ąĪ. ą»ą║ąŠą▒ąĖ. ą×ąĮ čüąŠčüč鹊ąĖčé ąĖąĘ ą╝ąĄą┤ąĮąŠą╣ ąĖ čåąĖąĮą║ąŠą▓ąŠą╣ ą┐ą╗ą░čüčéąĖąĮ, ą┐ąŠą│čĆčāąČąĄąĮąĮčŗčģ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ ą▓ čĆą░čüčéą▓ąŠčĆčŗ CuSO4 ąĖ ZnSO4. ąĀą░čüčéą▓ąŠčĆ CuSO4 ąĘą░ą║ą╗čÄč湥ąĮ ą▓ ą┐ąŠčĆąĖčüčéčŗą╣ ą║ąĄčĆą░ą╝ąĖč湥čüą║ąĖą╣ čåąĖą╗ąĖąĮą┤čĆ (ą┤ąĖą░čäčĆą░ą│ą╝ą░), ą║ąŠč鹊čĆčŗą╣ čĆą░ąĘą╝ąĄčēąĄąĮ ą▓ čüč鹥ą║ą╗čÅąĮąĮčŗą╣ čüąŠčüčāą┤ ą▒ąŠą╗čīčłąĄą│ąŠ čĆą░ąĘą╝ąĄčĆą░ čü čĆą░čüčéą▓ąŠčĆąŠą╝ ZnSO4. ąöą▓ąĖąČąĄąĮąĖąĄ ąĖąŠąĮąŠą▓ ąĖąĘ ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ ą▓ ą┤čĆčāą│ąŠą╣ ąŠčüčāčēąĄčüčéą▓ą╗čÅąĄčéčüčÅ č湥čĆąĄąĘ ą┤ąĖą░čäčĆą░ą│ą╝čā. ąØą░ą┐čĆčÅąČąĄąĮąĖąĄ ąĮą░ ą║ą╗ąĄą╝ą░čģ 菹╗ąĄą╝ąĄąĮčéą░ ąöą░ąĮąĖ菹╗čÅ-ą»ą║ąŠą▒ąĖ 1,1 ąÆ.
ąōą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąĖą╣ 菹╗ąĄą╝ąĄąĮčé ąøąĄą║ą╗ą░ąĮčłąĄ, čĆą░ąĘčĆą░ą▒ąŠčéą░ąĮąĮčŗą╣ ą▓ 1877 ą│ąŠą┤čā čäčĆą░ąĮčåčāąĘčüą║ąĖą╝ ąĖąĮąČąĄąĮąĄčĆąŠą╝ ą¢. ąøąĄą║ą╗ą░ąĮčłąĄ, ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ąĖ ą▓ ąĮą░čüč鹊čÅčēąĄąĄ ą▓čĆąĄą╝čÅ ą▓ ą║ą░č湥čüčéą▓ąĄ čüčāčģąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ ą┤ą╗čÅ ą┐ąĖčéą░ąĮąĖčÅ ą║ą░čĆą╝ą░ąĮąĮčŗčģ č乊ąĮą░čĆąĄą╣ ąĖ 菹╗ąĄą║čéčĆąŠąĮąĮčŗčģ čāčüčéčĆąŠą╣čüčéą▓. ąÆ 菹╗ąĄą╝ąĄąĮč鹥 ąøąĄą║ą╗ą░ąĮčłąĄ čĆąĄą░ą╗ąĖąĘčāąĄčéčüčÅ čüą╗ąĄą┤čāčÄčēą░čÅ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ą░čÅ čåąĄą┐čī:
C | NH4Cl | Zn
ą¤ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ čÅą▓ą╗čÅąĄčéčüčÅ čāą│ą╗ąĄčĆąŠą┤ (ą│čĆą░čäąĖčé), ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ čÅą▓ą╗čÅąĄčéčüčÅ čåąĖąĮą║ (ą▓ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮčŗčģ ą╝ąŠą┤ąĖčäąĖą║ą░čåąĖčÅčģ čŹč鹊ą│ąŠ ą│ą░ą╗čīą▓ą░ąĮąĖč湥čüą║ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░, ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ą┐ąŠą╗čÄčüąŠą╝ čüą╗čāąČą░čé čüč鹥ąĮą║ąĖ čüąŠčüčāą┤ą░). ąŁą╗ąĄą║čéčĆąŠą╗ąĖč鹊ą╝ čÅą▓ą╗čÅąĄčéčüčÅ ąČąĄą╗ą░čéąĖąĮąĖčĆąŠą▓ą░ąĮąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ čģą╗ąŠčĆąĖą┤ą░ ą░ą╝ą╝ąŠąĮąĖčÅ. ąÆąŠą║čĆčāą│ ą│čĆą░čäąĖč鹊ą▓ąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą┤ą░ čĆą░ąĘą╝ąĄčēą░ąĄčéčüčÅ ą╝ąĄą╗ą║ąŠ čĆą░ąĘą┤čĆąŠą▒ą╗ąĄąĮąĮčŗą╣ ąŠą║čüąĖą┤ ą╝ą░čĆą│ą░ąĮčåą░(IV) MnO2, ą║ąŠč鹊čĆčŗą╣ ąŠą║ąĖčüą╗čÅąĄčé ąŠą▒čĆą░ąĘčāčÄčēąĖą╣čüčÅ ą▓ąŠą┤ąŠčĆąŠą┤ ą▓ ą▓ąŠą┤čā. ąØą░ą┐čĆčÅąČąĄąĮąĖąĄ ąĮą░ ą║ą╗ąĄą╝ą░čģ 菹╗ąĄą╝ąĄąĮčéą░ ąøąĄą║ą╗ą░ąĮčłąĄ čüąŠčüčéą░ą▓ą╗čÅąĄčé 1,5 ąÆ.










