Пероксид водорода – формула и строение. Молекула пероксида водорода H2O2 содержит пероксо-группу -O-O-; степени окисления элементов: H+I2O-I2.
Получение пероксида водорода.
- Действие серной кислоты на пероксид бария(II) (лабораторный способ):
BaO2 + H2SO4 = BaSO4 + H2O2
- Электролиз умеренно концентрированного водного раствора серной кислоты или ее солей при высокой плотности тока и последующим гидролизом образующейся пероксодисерной кислоты H2S2O8 (старый промышленный способ):
Анод: 2SO42- – 2e– = S2O6(O2)2-;
S2O6(O2)2- + 2H+ ⇄ H2S2O8
S2O6(O2)2- + 4H2O = 2SO42- + 2 H3O+ + H2O2
При электролизе солей анодный процесс проводят при подкислении. Пероксид водорода отделяют отгонкой в вакууме.
- Окисление этилантрагидрохинона кислородом воздуха, при этом образуется почти безводный продукт (современный промышленный способ):
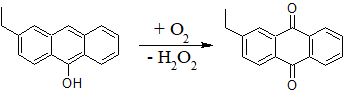
Свойства пероксида водорода. В чистом (свободном от воды) виде пероксид водорода представляет собой светло-голубую жидкость. Очень взрывоопасен! В продажу поступает обычно 30% водный раствор – пергидроль. В аптеках продают 3% водный раствор пероксида водорода.
На свету, под действием катализаторов (пыль, кровь, пиролюзит MnO2, платина, фермент каталаза) пероксид водорода легко разлагается:
2H2O2 = 2H2O + O2
Пероксид водорода проявляет сильные окислительные свойства в кислой среде:
H2O2 + 2H+ + 2e– = 2H2O; E0 = +1,764 B
но может проявлять и восстановительные свойства:
H2O2 – 2e– = O2 + 2H+; E0 = +0,694 B
В виде чистого вещества или концентрированного раствора пероксид водорода опасен в обращении, т.к. вызывает ожоги кожи (белые пятна, которые через некоторое время исчезают).
Применение пероксида водорода. Пероксид водорода эффективное отбеливающее (волосы, хлопок, бумага) и дезинфицирующее средство, окислитель в ракетном топливе, сырье для синтеза неорганических и органических пероксосоединений.










