Электрохимическая коррозия – это разрушение металлов и сплавов вследствие протекания на их поверхности электрохимических реакций
Электрохимическая коррозия развивается при контакте металлов с раствором электролита.
При электрохимической коррозии на металле протекают одновременно два процесса:
- Анодный процесс: Окисление металла
Мe0 – ne– = Men+
- Катодный процесс: Восстановление окислителя (например кислорода или катионов водорода (точнее катионов оксония)
Кислородная коррозия: О2 + 2Н2О + 4е– = 4ОН–
Водородная коррозия: 2Н3О+ + 2е– = Н2 + 2Н2О
Кислородная коррозия протекает в нейтральных и основных растворах.
Водородная коррозия протекает в кислых растворах.
Электролитом может быть пленка воды, которая появляется в результате конденсации влаги на поверхности любого металла. Скорость электрохимической коррозии зависит от электропроводности раствора электролита. Чистая вода – плохой проводник электрического тока, атмосферная вода проводит электрический ток значительно лучше в основном из-за растворенного в ней CO2 и образования электролита – угольной кислоты H2CO3. Электропроводность атмосферной воды увеличивают промышленные газовые выбросы SO2 (образуется в основном из серосодержащих примесей присутствующих в угле, при его сжигании), который вызывает значительную кислотность атмосферной воды:
SO2*H2O + H2O ⇄ HSO3– + H3O+; pH < 7
Коррозионная опасность промышленных газов, выбрасываемых в атмосферу, довольно значительна.
Особенно коррозионно опасным может быть место контакта двух разнородных металлов. Электрохимическая коррозия, которая развивается при контакте двух металлов, имеющих разные потенциалы в данном электролите, называют контактная коррозия. Коррозия металла с более отрицательным потенциалом обычно усиливается, а коррозия металла с более положительным потенциалом замедляется. Для протекания контактной коррозии достаточно присутствия примесей на поверхности металла.
Пример.
Процесс электрохимической коррозии в месте контакта железа и меди под действием атмосферной воды, содержащей растворенный кислород воздуха, протекает следующим образом.

Железо окисляется до катионов Fe2+, которые переходят в воду:
Fe0 – 2e– = Fe2+
Электроны переходят в медь и восстанавливают растворенный в воде кислород в гидроксид ионы:
O2 + 2H2O + 4e– = 4OH–
В воде ионы Fe2+ и OH– взаимно осаждают друг друга в виде практически нерастворимого гидроксида железа(II):
Fe2+ + 2OH– = Fe(OH)2
Затем атмосферный кислород окисляет часть гидроксида железа(II), в соединение метагидроксид железа(III). FeO(OH) с Fe(OH)2 при высыхании капли образует ржавчину – бурый рыхлый порошок:
4Fe(OH)2 + O2 = 4FeO(OH) + 2H2O
Fe(OH)2 + 2FeO(OH) = (Fe+IIFe+III2)O4 + 2H2O
Существуют различные способы защиты от коррозии, основанные на снижении агрессивности коррозионной среды, нанесении защитных покрытий и применении электрохимических методов – электрохимическая защита от коррозии.
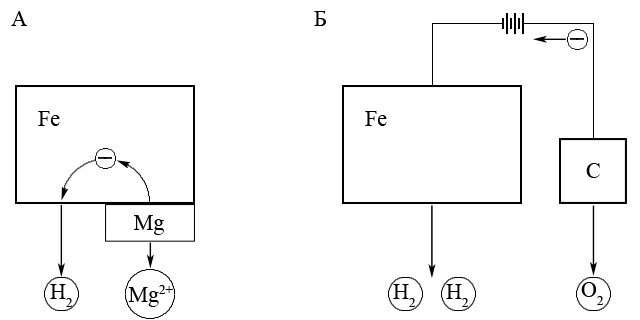
Один из видов электрохимической защиты – катодная защита заключается в том, что металл который защищают соединяют с отрицательным полюсом внешнего источника тока, который будет окисляться и тем самым защищать основной металл.
Другой вид электрохимической защиты – протекторная защита осуществляется путем присоединения к металлу, который надо защитить от коррозии, протектора – более активного (т.е. менее благородного металла), который легче окисляется и таким образом защищает основной металл от коррозионного окисления. Например, для защиты от коррозии изделий из железа и его сплавов в качестве протектора обычно применяют более активный магний.
Электрохимическая защита используется в различных отраслях промышленности. Например для защиты корпусов кораблей от коррозии.










