Електрохімічна корозія – це руйнування металів і сплавів внаслідок протікання на їх поверхні електрохімічних реакцій
Електрохімічна корозія розвивається при контакті металів з розчином електроліту.
При електрохімічній корозії на металі протікають одночасно два процеси:
- Анодний процес: Окиснення металу
Мe0 – ne– = Men+
- Катодний процес: Відновлення окисника (наприклад кисню або катіонів гідрогену (точніше катіонів оксонію)
Киснева корозія: О2 + 2Н2О + 4е– = 4ОН–
Воднева корозія: 2Н3О+ + 2е– = Н2 + 2Н2О
Киснева корозія протікає у нейтральних і основних розчинах.
Воднева корозія протікає в кислих розчинах.
Електролітом може бути плівка води, яка з’являється в результаті конденсації вологи на поверхні будь-якого металу. Швидкість електрохімічної корозії залежить від електропровідності розчину електроліту. Чиста вода – поганий провідник струму, атмосферна вода проводить електричний струм значно краще в основному через розчинений в ній карбон діоксид і утворення електроліту – карбонової кислоти H2CO3. Електропровідність атмосферної води збільшують промислові газові викиди SO2 (утворюється в основному із сульфурвмісних домішків присутніх у вугіллі, при його спалюванні), який викликає значну кислотність атмосферної води:
SO2*H2O + H2O ⇄ HSO3– + H3O+; pH < 7
Корозійна небезпека промислових газів, які викидаються в атмосферу, доволі значна.
Особливо корозійно небезпечним може бути місце контакту двох різнорідних металів. Електрохімічна корозія, яка розвивається при контакті двох металів, що мають різні потенціали у даному електроліті, називаються контактна корозія. Корозія металу с більш негативним потенціалом зазвичай посилюється, а корозія металу з більш позитивним потенціалом уповільнюється. Для протікання контактної корозії достатньо присутності домішок на поверхні металу.
Приклад.
Процес електрохімічної корозії у місці контакту заліза і міді під дією атмосферної води, що містить розчинений кисень повітря, протікає наступним чином.

Залізо окиснюється до катіонів Fe2+, які переходять у воду:
Fe0 – 2e– = Fe2+
Електрони переходять в мідь і відновлюють розчинений у воді кисень до гідроксид іонів:
O2 + 2H2O + 4e– = 4OH–
У воді йони Fe2+ та OH– взаємно осаджують одне одного у вигляді практично нерозчинного ферум(ІІ) гідроксиду:
Fe2+ + 2OH– = Fe(OH)2
Потім атмосферний кисень окиснює частину ферум(ІІ) гідроксиду, до сполуки ферум(III) метагідроксид. FeO(OH) з Fe(OH)2 при висиханні краплі утворює іржу – бурий пухкий порошок:
4Fe(OH)2 + O2 = 4FeO(OH) + 2H2O
Fe(OH)2 + 2FeO(OH) = (Fe+IIFe+III2)O4 + 2H2O
Існують різні способи захисту від корозії, засновані на зниженні агресивності корозійного середовища, нанесенні захисних покриттів і застосуванні електрохімічних методів – електрохімічний захист від корозії.
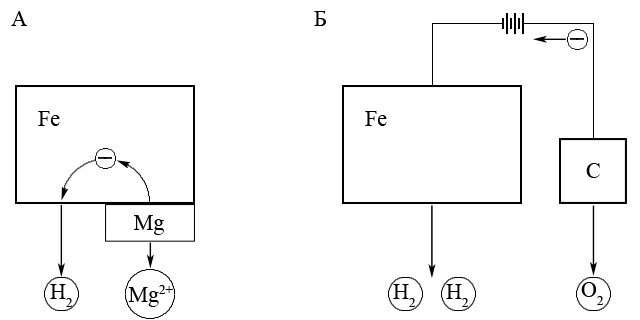
Катодний захист від корозії з використання зовнішнього електричного струму (А) і анода-протектора (Б)
Один з видів електрохімічного захисту – катодний захист полягає у тому, що метал який захищають з’єднують з негативним полюсом зовнішнього джерела струму, який буде окиснюватися і таким чином захищати основний метал.
Інший вид електрохімічного захисту – протекторний захист здійснюється шляхом приєднання до металу, який треба захистити від корозії, протектору – більш активного (тобто менш благородного металу), який легше окиснюється і таким чином захищає основний метал від корозійного окиснення. Наприклад, для захисту від корозії виробів із заліза і його сплавів в якості протектора зазвичай застосовують більш активний магній.
Електрохімічний захист використовується в різних галузях промисловості. Наприклад для захисту корпусів кораблей від корозії.










