Кількісні розрахунки оборотних реакцій можна проводити використовуючи закон діючих мас (закон дії мас), який був відкритий в 1867 році норвезьким вченим математиком Гульдбергом і хіміком Вааге.
Гульдберг і Вааге знайшли, що хімічна дія речовини пропорційна її активній масі. Під активною масою вони розуміли концентрацію – частка від ділення маси на об’єм. Гульдберг і Вааге мали на увазі ту саму величину, яку сьогодні називають активністю, і яка прирівнюється до аналітичної концентрації в при незначному вмісту речовини.
Стосовно до простих гомогенних реакцій типу A + B ⇄ C + D, в яких всі стехіометричні коефіцієнти дорівнюють одиниці, Закон діючих мас формулюється так:
Хімічна реакція знаходиться в стані рівноваги, якщо відношення добутку концентрацій продуктів до добутку концентрацій реагентів досягає постійного значення, характерного для цієї реакції при даній температурі
Математичне вираження закону діючих мас через концентрації речовин c або активності a для простих реакцій:
A + B ⇄ C + D
(cC * cD) / (cA * cB) = Kc
(aC * aD) / (aA * aB) = Ka
Закон діючих мас універсальний і його можна використовувати для розрахунків незалежно від складності реакції.
Для проведення практичних розрахунків вираз закону діючих мас записують через концентрації, що відповідають стану хімічної рівноваги; такі концентрації позначають формулами речовин, укладених в квадратні дужки:
Kc = ([C][D]) / ([A][B]) = const = f (T)
Величина Kc називається Константа рівноваги. Вона залежить тільки від температури.
Приклад. Для оборотної гомогенної реакції конверсії карбон(II) оксиду водяною парою (конверсія водяного газу) константа рівноваги дорівнює
CO + H2O ⇄ CO2 + H2 (T = 800 K)
Kc = ([CO2][H2]) / ([CO][H2O]) = 4
Зазвичай в законі діючих мас вміст кожної речовини задають через її рівноважну молярну концентрацію (моль/дм3), але закон діючих мас може бути записаний і з зазначенням рівноважних мольних часток або рівноважних парціальних тисків речовин.
Запис закону діючих мас через молярні концентрації зручний для реакцій, що протікають в розчинах. Молярні частки зручніше використовувати для опису реакцій між газоподібними речовинами.
Мольна частка речовини – це відношення формульної кількості речовини до суми формульних кількостей всіх речовин які складають суміш:
x(B) = n(B) / (n(A) + n(B) + n(C) + n(D)) = n(B) / Σn(A-D)
До оборотних газових реакцій закон діючих мас виражений через мольні частки має наступний вигляд:
A + B ⇄ C + D
Kx = (xC * xD) / (xA * xB) = const = f (T)
Приклад. В реакції конверсії водяного газу стан рівноваги при 800 K встановився таким чином, що з початкових кількостей речовин CO і H2O, які дорівнювали по 3 моль для кожної речовини, утворилося по 2 моль продуктів (CO2 і H2):
вихідна суміш – 3CO + 3H2O → CO + H2O + 2CO2 + 2H2 – рівноважна суміш
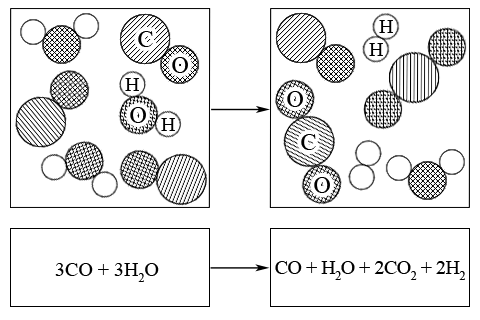
Рівноважні мольні частки речовин в реакційній суміші дорівнюють (сумарна кількість всіх речовин становить 6 моль):
x(CO2) = 2/6; x(H2) = 2/6; x(CO) = 1/6; x(H2O) = 1/6
звідки
Kx = (x(CO2) * x(H2)) / (x(CO) * x(H2O)) = ((2/6) * (2/6)) / ((1/6) * (1 / 6)) = 4 (T = 800 K)
Для складних гомогенних реакцій, рівняння яких містять коефіцієнти при формулах (стехіометричні коефіцієнти) більші за одиницю, в вираженні закону діючих мас необхідно враховувати ці коефіцієнти.
Коефіцієнти рівняння хімічної реакції в вираженні закону діючих мас є показниками ступенів відповідних рівноважних концентрацій
aA + bB ⇄ cC + dD
Kc = ([C]c[D]d) / ([A]a[B]b) = const = f (T)
Приклад. Для оборотної реакції синтезу амоніаку вираз константи рівноваги матиме такий вигляд:
N2 + 3H2 ⇄ 2NH3
Kc = ([NH3]2) / ([N2][H2]3)
Для кожної хімічної реакції при T = const величина Kc має певне, властиве тільки цій реакції значення і при зміні температури значення Kc даної реакції змінюється. Константа рівноваги реакцій може бути розрахована за експериментальними даними; для багатьох реакцій значення Kc наведені в довідниках.
У вираженні закону діючих мас концентрації продуктів знаходяться в чисельнику, а концентрації реагентів – в знаменнику, тому справедливими є наступні твердження:
Чим вище константа рівноваги, тим більшою мірою в рівноважної реакційної суміші переважають продукти;
Чим нижче константа рівноваги, тим більшою мірою в рівноважної реакційної суміші переважають реагенти
Для гомогенних реакцій типу
A + B ⇄ C + D
і всіх інших реакцій, в яких сумарна кількість продуктів дорівнює сумарній кількості реагентів, справедливі наступні закономірності:
- Kc > 1 – переважають продукти, концентрації продуктів більші за концентрації реагентів;
- Kc = 1 – концентрації реагентів і продуктів однакові;
- Kc < 1 – переважають реагенти, концентрації реагентів більші за концентрації продуктів.
Ці ж висновки виходять при підстановці відповідних значень Kc в вираз для розрахунку стандартної енергії Гіббса реакції.
Якщо в оборотній реакції, крім газів, беруть участь тверді і нелеткі рідкі речовини, то вираз закону діючих мас набуває вигляду:
A (газ) + B (т) ⇄ C (ж) + D (газ)
Kc = [D] / [A] = const = f (T)
Концентрації твердих і рідких речовин, які дорівнюють відношенню щільності речовини ρ до його молярної маси M
c = n / V = (m / M) / (m / ρ) = ρ / M = const = f (T)
входять як константи при T = const в величину Kc і тому відсутні в правій частині виразу для закону діючих мас.
Приклад. Виразами для Kc наступних реакцій будуть:
C (т) + CO2 (газ) ⇄ 2CO (газ); Kc = [CO]2 / [CO2]
MgCO3 (т) ⇄ MgO (т) + CO2 (газ); Kc = [CO2]
H2O (газ) + SO3 (газ) ⇄ H2SO4 (ж); Kc = 1 / ([H2O] [SO3])
Так само в розчині не враховуються тверді фази (осади):
Ca2+ + 2F– ⇄ CaF2 (т); Kc = 1 / ([Ca2+][F–]2)
Cu2+ + Zn (т) ⇄ Cu (т) + Zn2+; Kc = [Zn2+] / [Cu2+]










