Нітроген оксиди
В оксидах нітроген має ступені окиснення від (+I) до (+V). Тільки оксиди N2O3 і N2O5 можна вважати кислотними; іноді NO2 і N2O4 одночасно розглядаються як оксиди двох кислот. Нітрозні гази складаються з NO, NO2 і N2O4.
Нітроген(I) оксид (звеселяючий газ) N2O – безбарвний газ з приємним, злегка солодкуватим запахом, температура кипіння -88,5*С. Помірно розчинний у воді. Утворюється при нагріванні амоній нітрату:
NH4NO3 = N2O + 2H2O
При вдиханні нітроген(I) оксиду в перший момент він викликає у людини збудження, а потім – діє заспокійливо. У суміші з киснем використовується в медицині як наркотичний засіб.
Нітроген(II) оксид NO – безбарвний газ, який на повітрі поступово набуває коричнево-бурого забарвлення, внаслідок протікання реакції:
2NO + O2 = 2NO2
Температура кипіння -152*С. Практично нерозчинний у воді. Отримують при взаємодії розведеної нітратної кислоти з багатьма металами, наприклад з міддю; утворюється при електричному розряді в грозовій атмосфері (блискавка). Нітроген(II) оксид є проміжним продуктом технічного синтезу нітратної кислоти.
Нітроген(III) оксид N2O3 – при низьких температурах темно-синя рідина, розкладається при температурі вище 0*С на суміш NO і NO2. Кислотний оксид при взаємодії з охолодженою водою утворює нітритну кислоту HNO2. З лугами у водному розчині дає відповідні нітрити.
Нітроген(IV) оксид NO2 – червоно-коричневий (бурий) газ зі своєрідним запахом. Конденсується при 21,2*C і твердне при -10,2*С (рідина і кристали безбарвні). Дуже отруйний! При тривалому впливі NO2 (5 – 25 годин) з’являються ознаки важкого отруєння, головним чином набряк легенів.
При взаємодії нітроген діоксиду з лугами утворюється суміш нітритів і нітратів (тому NO2 – оксид двох кислот):
2NO2 + 2KOH = KNO2 + KNO3 + H2O
Нітроген діоксид входить до складу “нітрозних газів” газової суміші, що виділяється при взаємодії нітратної кислоти (різної концентрації) з металами, при термічному розкладі нітратної кислоти і нітратів важких металів, при взаємодії нітритів з сильними кислотами, а також при автогенному зварюванні або при блискучому травленні мідних і латунних виробів.
Мономерна форма нітроген діоксиду (NO2) завжди знаходиться в рівновазі з її безбарвним (в газоподібному і рідкому станах) димером – дінітроген(IV) тетраоксид N2O4
2NO2 ⇄ N2O4
При 64*С приблизно половина N2O4 знаходиться у вигляді NO2, при більш високих температурах вміст NO2 збільшується.
Нітроген(V) оксид N2O5 – безбарвні вибухові кристали. Отримують при зневодненні P4O10 охолодженої нітратної кислоти:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
N2O5 – кислотний оксид, бурхливо реагує з водою, утворюючи нітратну кислоту HNO3.
Нітратна кислота. Нітрати
Нітратна кислота
HNO3 (іноді зручніше писати HO-NO2); у водному розчині повністю переходить в іони H3O+ і NO3–.
Отримання нітратної кислоти.
- Каталітичне окиснення амоніаку (спосіб Оствальда, який використовується в промисловості з 1915 року). В основі способу такі реакції:
4NH3 + 5O2 ⇄ 4NO + 6H2O; ΔH0 = -904 кДж (реакція 1)
2NO + O2 ⇄ 2NO2 (реакція 2)
4NO2 + O2 + 2H2O = 4HNO3 (реакція 3)
Суміш амоніаку з повітрям дуже швидко пропускають через каталізатор – нагріту сітку з платини і родію (2000 отворів на 1 см2); тривалість контакту реакційної суміші з каталізатором 0,0002 с.
При 800*С протікає реакція (1). Після охолодження NO окиснюється киснем до нітроген діоксиду NO2, реакція (2), з якого при 0,5 – 1,0 МПа в поглинальних вежах при контакті з водою (або з розведеною нітратною кислотою) отримують кінцевий продукт – концентровану (60%) нітратну кислоту, реакція (3). Утворення нітратної кислоти в цьому процесі можна відобразити наступними послідовно-паралельними стадіями:
3NO2 + H2O → 2HNO3 + NO
2NO + O2 → 2NO2
- Нагрівання натрій нітрату з концентрованою сульфатною кислотою:
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
Старий промисловий спосіб, в якості сировини використовується натронна селітра.
Властивості нітратної кислоти. Безвода (100%) нітратна кислота являє собою безбарвну рідину з сильним запахом, температура кипіння 86*С (екстрапольоване значення). При зберіганні на світлі нітратна кислота поступово фарбується в червоно-коричневий (бурий) колір внаслідок розкладання з утворенням вищих нітроген оксидів (в тому числі забарвленого NO2). Продукція, що випускається промисловістю (60-68%) нітратна кислота кипить при 122*С (азеотропна суміш з водою). Концентрована нітратна кислота, яка містить багато молекул HNO3, діє як сильний окислювач, але в процесі реакції нітратна кислота розбавляється, окислювальна активність кислоти знижується. Продуктом відновлення нітратної кислоти є нітрозні гази. Концентрована нітратна кислота легко окиснює солому, деревину, фосфор і багато металів, в тому числі такі як мідь, ртуть і срібло.
Нітратна кислота з неметалами реагує з утворенням NO2 або NO:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Нітратна кислота з металами реагує з утворенням різних продуктів, в залежності від концентрації нітратної кислоти і активності металу:
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (розб.) = 3Cu(NO3)2 + 2NO + 4H2O
Нітратна кислота не взаємодіє з золотом і платиною, ці метали можуть бути переведені в розчин тільки при обробці царською водкою – сумішшю концентрованих розчинів HCl і HNO3 в об’ємному співвідношенні 3 : 1. Дія царської водки пояснюється тим, що нітратна кислота окисляє хлоридну кислоту з виділенням вільного хлору і утворенням нітроген(III) хлороксиду NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl
Нітроген(III) хлороксид є проміжним продуктом реакції і розкладається:
2NOCl = 2NO + Cl2
Хлор в момент виділення складається з атомів, що й обумовлює високу окисну дію царської водки:
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2O
Деякі метали не реагують з нітратною кислотою через їх пасивацію – утворення стійкої оксидної плівки. Наприклад, алюміній і залізо стійкі до дії холодного розчину HNO3, a хром стійкий до дії гарячого розчину нітратної кислоти. У сильно розведеній нітратній кислоті немає молекул (існують тільки іони H3O+ і NO3–), тому така HNO3 не реагує з міддю та іншими благородними металами. Розбавлена нітратна кислота реагує з металами, що стоять лівіше гідрогену в електрохімічному ряді напруг з утворенням нітроген(I) оксиду.
4Mg + 10HNO3 (розб.) = 4Mg(NO3)2 + N2O + 5H2O
Дуже розбавлена нітратна кислота, реагує з активними металами з утворенням амоній нітрату:
4Zn + 10HNO3 (дуже розб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Концентрована нітратна кислота діє на вуглеводні, особливо ароматичні, і утворює або нітросполуки (містять нітрогрупу -NO2), або складні ефіри – нітрати (містять нітратну групу -ONO2). Зазвичай для нітрування вуглеводнів використовується нітруюча суміш, яка складається з концентрованих HNO3 і H2SO4 кислот. Забарвлення білкових тіл, зокрема шкіри, в жовтий колір при їх контакті з концентрованою нітратною кислотою – ксантопротеїнова реакція – також є процесом нітрування.
Виявлення нітратної кислоти.
- При нейтралізації нітратної кислотою основою органічної природи – нітроном – утворюється білий осад.
- Розчин, що містить іони NO3– і Fe2+, наливають на шар концентрованої H2SO4; в місці зіткнення рідин утворюється буре кільце, яке вказує на утворення комплексу [Fe(NO)(H2O)5]2+ – катіон пентаакванітрозілійферум(II).
Застосування нітратної кислоти. Нітратна кислота – один з основних продуктів багатотоннажної хімічної промисловості. Приблизно 75% HNO3, одержуваної в промисловості, використовується для виробництва добрив, 15% – для виробництва вибухових речовин і 10% – для інших цілей. Основні хімічні продукти, вироблені з використанням нітратної кислоти, шляхи їх отримання та сфери застосування показані на схемі.
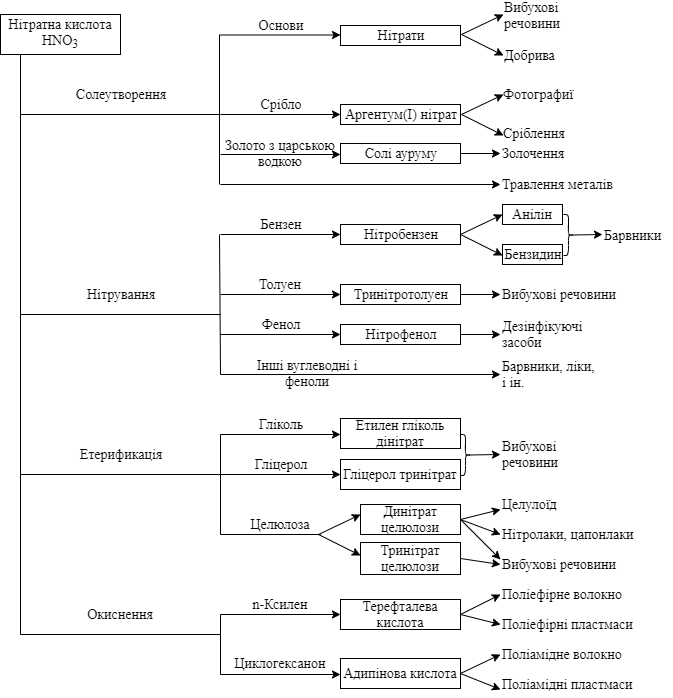
Нітрати
Солі та ефіри нітратної кислоти називають нітрати. Тривіальні назви деяких нітратів: KNO3 – калійна (індійська) селітра; NaNO3 – натронна (чилійська) селітра; NH4NO3 – амонійна селітра; Ca(NO3)2 – вапняна (норвезька) селітра; Ba(NO3)2 – баритова селітра; AgNO3 – пекельний камінь (ляпіс).
Нітрати всіх металів добре розчиняються у воді. При нагріванні нітрати розкладаються, продукти розкладання залежать від природи нітрату:
- Нітрати лужних металів розкладаються на нітрит і кисень:
KNO3 = KNO2 + O2
- Нітрати інших металів розкладаються на оксид металу (або метал у вільному вигляді, якщо оксид термічно нестійкий), нітроген діоксид і кисень:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
- Амоній нітрат розкладається на нітроген(I) оксид і воду:
NH4NO3 = N2O + 2H2O










