Мірою схильності речовин до окиснення і відновлення є електродний потенціал. Якщо занурити пластинку деякого металу у водний розчин його власної солі (Сu в розчин CuSO4 або Zn в розчин ZnSO4), то в такій системі принципово можливе протікання двох протилежних електрохімічних процесів:
- Катіони можуть відновлюватися і осаджуватися у вигляді атомів з розчину солі на метал. Для компенсації заряду іонів в розчині витрачаються електрони з зануреної в розчин металевої пластини, тому в атомі металу виникає нестача електронів):
Men+ + ne– = Мe0
- Атоми металу можуть окиснюватися і переходити в розчин, а електрони залишаються в металі і обумовлюють їх надлишок:
Me0 + ne– = Мen+
Схильність катіонів до відновлення зазвичай зростає з підвищенням концентрації солі в розчині.
Схильність металів до окиснення залежить від хімічної природи металу.
Наприклад, для цинку схильність до окиснення значно вища, ніж для купруму. Якщо уявити, що концентрації речовин в розчині однакові, то цинк надасть в розчин більшу кількість катіонів, ніж купрум, а отже, на цинковій пластині залишиться більше електронів. Завдяки електростатичному тяжінню між катіонами і електронами катіони утримуються поблизу поверхні металу – утворюється подвійний електричний шар і з’являється різниця електричних потенціалів (або гальвані-потенціал). Подібна система, що має вигляд металу зануреного у розчин електроліту, називається електродом.
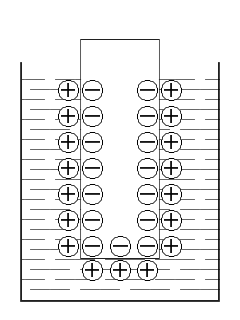
На схемі зображено виникнення подвійного електричного шару при зануренні металевої пластини в розчин солі металу з якого вона виготовлена.
Електрод – це система з двох струмопровідних тіл: провідників І та ІІ роду.
Провідники І роду – це речовини в яких носієм електричного заряду є електрони. До провідників І роду відносяться метали, сплави, оксиди з металевою провідністю, а також неметалеві матеріали, зокрема графіт.
Провідники ІІ роду – це речовини в яких носієм електричного заряду є іони. До провідників ІІ роду відносяться розплави і розчини електролітів.
Пристрій, що складається з двох електродів, називається гальванічний елемент. Абсолютне значення різниці потенціалів яке виникае на межі метал | електроліт, тобто гальвані-потенціал виміряти не можна ніякими засобами, оскільки він виникає між двома фазами різної природи (твердий метал | рідкий розчин). Однак можна виміряти різницю гальвані-потенціалів двох хімічно різних електродів, прийнявши один з електродів за електрод порівняння. В якості електроду порівняння зазвичай використовують електрод Н+/Н2 (газ) – Гідрогенний електрод (стара назва водневий електрод), який запропонував німецький фізико-хімік Нернст.
Цей електрод складається з платинової пластини, покритої платиновою черню (для збільшення активної поверхні електрода), яка занурена в розчин, що містить катіони гідрогену (катіони оксонію) зазвичай розчин НСl або H2SO4. Через розчин безперервно пропускають газоподібний водень під постійним тиском. Гідрогенний електрод вводять в електричний контакт з досліджуваним електродом за допомогою з’єднувального струмопровідного містка, в якості якого використовують скляну трубку, заповнену розчином електроліту, зазвичай КСl. Таким чином отримують гальванічний елемент. Використовуючи компенсаційний метод, вимірюють різницю потенціалів між електродами, тобто електрорушійну силу цього елемента.
Щоб можна було порівнювати значення різниці потенціалів різних електродів, необхідно виконувати експерименти в стандартних умовах. В якості стандартних умов прийняті умови: температура 25*С (298,15К), тиск 101,325 кПа (1 атм), концентрація іонів 1 моль/дм3 (при точних розрахунках замість аналітичної концентрації використовують активність електролітів). В електроді порівняння, який називають стандартний гідрогенний електрод, підтримується концентрація катіонів гідрогену 1 моль/дм3 і тиск газоподібного Н2 101,325 кПа (1 атм). Різниця потенціалів стандартного гідрогенного електрода і будь-якого іншого електрода (метал / розчин солі металу), вимірювана при стандартних умовах, називається стандартний електродний потенціал (позначення Е0).
Стандартний потенціал стандартного гідрогенного електрода умовно прийнятий за нуль.
Стандартний гідрогенний електрод складно відтворити практично. Необхідний чистий водень з постійною швидкістю його подачі. Найчастіше замість стандартного гідрогенного електроду використовують інші електроди порівняння, наприклад каломельний електрод Hg/Hg2Cl2.
Таблиця Стандартні потенціали пар Мen+/Мe0 в електрохімічному ряді напруг
|
Мen+/Мe0 |
E0, B |
|
Li+/Li |
-3,045 |
|
Rb+/Rb |
-2,925 |
|
K+/K |
-2,924 |
|
Cs+/Cs |
-2,923 |
|
Ra2+/Ra |
-2,916 |
|
Ba2+/Ba |
-2,905 |
|
Sr2+/Sr |
-2,888 |
|
Ca2+/Ca |
-2,864 |
|
Na+/Na |
-2,711 |
|
Ac3+/Ac |
-2,600 |
|
La3+/La |
-2,522 |
|
Y3+/Y |
-2,372 |
|
Mg2+/Mg |
-2,370 |
|
Sc3+/Sc |
-2,077 |
|
Th4+/Th |
-1,875 |
|
Be2+/Be |
-1,847 |
|
Al3+/Al |
-1,700 |
|
U3+/U |
-1,690 |
|
U4+/U |
-1,425 |
|
Ti3+/Ti |
-1,208 |
|
Mn2+/Mn |
-1,192 |
|
V2+/V |
-1,125 |
|
Cr2+/Cr |
-0,852 |
|
V3+/V |
-0,835 |
|
Zn2+/Zn |
-0,763 |
|
Ga3+/Ga |
-0,560 |
|
Fe2+/Fe |
-0,441 |
|
Cd2+/Cd |
-0,404 |
|
In3+/In |
-0,338 |
|
Tl+/Tl |
-0,336 |
|
Co2+/Co |
-0,277 |
|
Ni2+/Ni |
-0,234 |
|
Sn2+/Sn |
-0,141 |
|
Pb2+/Pb |
-0,126 |
|
Fe3+/Fe |
-0,037 |
|
H+/H2 |
0,000 |
|
BiIII/Bi |
+0,317 |
|
Cu2+/Cu |
+0,338 |
|
Cu+/Cu |
+0,518 |
|
Tl3+/Tl |
+0,741 |
|
Hg22+/Hg |
+0,796 |
|
Ag+/Ag |
+0,799 |
|
Hg2+/Hg |
+0,852 |
|
Pd2+/Pd |
+0,915 |
|
AuIII/Au |
+1,498 |
|
Au+/Au |
+1,691 |
Стандартні потенціали Е0 поширених металів Мen+/Мe0 завжди відносяться до певного електродного процесу, тобто до певного заряду і складу катіона металу в розчині. Так, для меркурія це можуть бути катіони Hg2+ і Hg22+, для феруму – катіони Fe2+ та Fe3+.
Залежно від того, позитивно чи негативно зарядженим виявляється металевий електрод щодо стандартного електрода, стандартний потенціал пари Мen+/Мe0 також буде мати позитивне або негативне значення.
Приклад.
Для цинк/гідрогенного гальванічного елемента, який складається з цинкового Zn2+/Zn0 і гідрогенного Н+/Н20 електродів, в стандартних умовах різниця потенціалів становить -0,763 В. Цинковий електрод є негативним полюсом гальванічного елемента, а гідрогенний електрод – позитивним полюсом.
Отже, стандартний потенціал пари Zn2+/Zn0 матиме таке саме значення (як по абсолютному числовому значенню, так і за знаком):
Zn2+ + 2e– = Zn0; E0 = -0,763B
Для мідь/гідрогенного гальванічного елемента, що складається з мідь Cu2+/Cu0 і водневого Н+/Н20 електродів, в стандартних умовах різниця потенціалів становить +0,338 В. Мідний електрод є позитивним полюсом гальванічного елемента, а гідрогенний електрод – негативним полюсом. Отже, стандартний потенціал пари Cu2+/Cu0 матиме таке саме значення:
Сu2+ + 2е– = Сu0; E0 = +0,338В
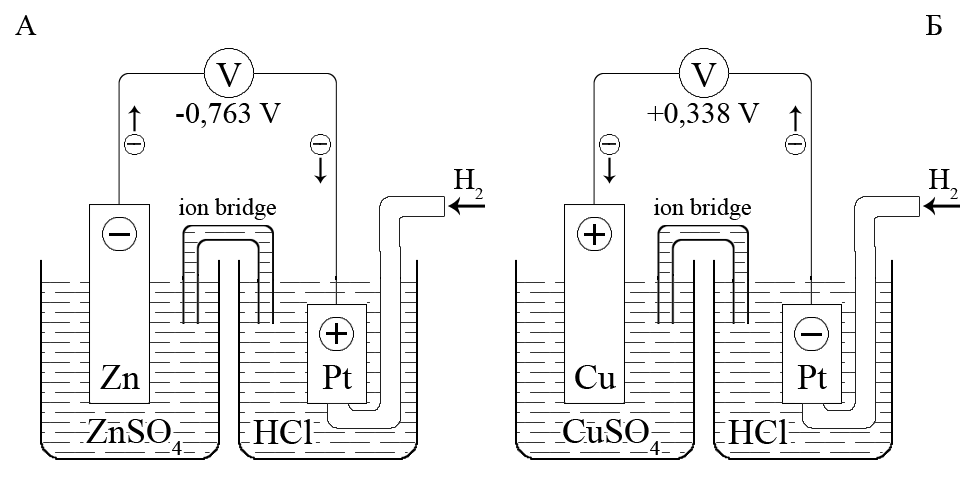
Схема гальванічного ланцюга зі стандартним гідрогенним електродом для визначення стандартного потенціалу електродів: A – цинкового; Б – мідного
Послідовність металів за зростанням стандартного потенціалу Е0 (від великих негативних до великих позитивних значень) відповідає електрохімічному ряду напруг. Така послідовність називається ряд стандартних електродних потенціалів. Порядок розташування в цьому ряді металів засновано на стандартних потенціалах конкретних пар Мen+/М0, а для неблагородних металів таких пар може бути більше однієї. Електродні процеси є особливим видом окисно-відновних реакцій, які відрізняються тим, що напів-реакції окиснення і відновлення протікають не в одному розчині, а є просторово розділеними.










