–Ü–æ–Ω–Ω—ñ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó – —Ü–µ —Ö—ñ–º—ñ—á–Ω—ñ –ø—Ä–æ—Ü–µ—Å–∏, —è–∫—ñ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –≤ —Ä–æ–∑—á–∏–Ω—ñ –∞–±–æ –≤ —Ä–æ–∑–ø–ª–∞–≤—ñ –º—ñ–∂ –≤—ñ–ª—å–Ω–∏–º–∏ —ñ–æ–Ω–∞–º–∏
–î–ª—è —ñ–æ–Ω–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ, —â–æ –≤–æ–Ω–∏ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –¥—É–∂–µ —à–≤–∏–¥–∫–æ (–ø—Ä–∞–∫—Ç–∏—á–Ω–æ –º–æ–º–µ–Ω—Ç–∞–ª—å–Ω–æ), —Ç–æ–º—É —â–æ –≤ —Ä–µ–∞–∫—Ü—ñ–π–Ω—ñ–π —Å–∏—Å—Ç–µ–º—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –º—ñ—Å—Ç—è—Ç—å—Å—è —É –≤–∏–≥–ª—è–¥—ñ —ñ–æ–Ω—ñ–≤, –≤–∂–µ –≥–æ—Ç–æ–≤–∏—Ö –≤—Å—Ç—É–ø–∞—Ç–∏ –≤ —Ö—ñ–º—ñ—á–Ω—É –≤–∑–∞—î–º–æ–¥—ñ—é. –£ —Ü—å–æ–º—É –ø–æ–ª—è–≥–∞—î —ó—Ö –≤—ñ–¥–º—ñ–Ω–Ω—ñ—Å—Ç—å –≤—ñ–¥ —Ä–µ–∞–∫—Ü—ñ–π –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏, –¥–ª—è –∑–¥—ñ–π—Å–Ω–µ–Ω–Ω—è —è–∫–∏—Ö –Ω–µ–æ–±—Ö—ñ–¥–Ω–æ –∑–∞–±–µ–∑–ø–µ—á–∏—Ç–∏ —Ä–æ–∑—Ä–∏–≤ —Ö—ñ–º—ñ—á–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –∑ –ø–æ–¥–∞–ª—å—à–∏–º —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º –Ω–æ–≤–∏—Ö –∑–≤’—è–∑–∫—ñ–≤. –¢–æ–º—É –º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ñ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –∑–Ω–∞—á–Ω–æ –ø–æ–≤—ñ–ª—å–Ω—ñ—à–µ, –Ω—ñ–∂ —ñ–æ–Ω–Ω—ñ.
–û–∫–∏—Å–Ω–æ-–≤—ñ–¥–Ω–æ–≤–Ω—ñ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó – —Ü–µ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó, —è–∫—ñ —Å—É–ø—Ä–æ–≤–æ–¥–∂—É—é—Ç—å—Å—è –∑–º—ñ–Ω–æ—é —Å—Ç—É–ø–µ–Ω—ñ –æ–∫–∏—Å–Ω–µ–Ω–Ω—è –µ–ª–µ–º–µ–Ω—Ç—ñ–≤
–•—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –æ–±–º—ñ–Ω—É – —Ü–µ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó, —è–∫—ñ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å —ñ–∑ –∑–±–µ—Ä–µ–∂–µ–Ω–Ω—è–º —Å—Ç—É–ø–µ–Ω—ñ –æ–∫–∏—Å–Ω–µ–Ω–Ω—è –µ–ª–µ–º–µ–Ω—Ç—ñ–≤
–°—Ç—É–ø—ñ–Ω—å –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ–π –æ–±–º—ñ–Ω—É –∑–∞ —É—á–∞—Å—Ç—é —ñ–æ–Ω—ñ–≤ —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –∑–∞–ª–µ–∂–∏—Ç—å –≤—ñ–¥ —Ç–æ–≥–æ, –≤ —è–∫—ñ–π –º—ñ—Ä—ñ —Å–µ—Ä–µ–¥ –ø—Ä–æ–¥—É–∫—Ç—ñ–≤ —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è —Å–ª–∞–±–∫—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏, –≥–∞–∑–∏, –º–∞–ª–æ—Ä–æ–∑—á–∏–Ω–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏, —è–∫—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å –æ—Å–∞–¥. –£ 1803 —Ä–æ—Ü—ñ —Ñ—Ä–∞–Ω—Ü—É–∑—å–∫–∏–π —Ö—ñ–º—ñ–∫ –ë–µ—Ä—Ç–æ–ª–ª–µ —Å—Ñ–æ—Ä–º—É–ª—é–≤–∞–≤ –ø—Ä–∞–≤–∏–ª–æ:
–ü—Ä–∞–≤–∏–ª–æ –ë–µ—Ä—Ç–æ–ª–ª–µ – –û–±–º—ñ–Ω–Ω—ñ —ñ–æ–Ω–Ω—ñ —Ö—ñ–º—ñ—á–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –ø—Ä–∞–∫—Ç–∏—á–Ω–æ –ø–æ–≤–Ω—ñ—Å—Ç—é, —è–∫—â–æ –ø—Ä–æ–¥—É–∫—Ç–∞–º–∏ —Ä–µ–∞–∫—Ü—ñ—ó —î –≥–∞–∑–∏, –æ—Å–∞–¥–∏ –∞–±–æ –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏
–Ý—ñ–≤–Ω—è–Ω–Ω—è —ñ–æ–Ω–Ω–∏—Ö —Ö—ñ–º—ñ—á–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π
–Ý–µ–∞–∫—Ü—ñ—ó –∑–∞ —É—á–∞—Å—Ç—é –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ (—ñ—Å—Ç–∏–Ω–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —ñ –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω–æ —Å–∏–ª—å–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤) –∑–∞–ø–∏—Å—É—é—Ç—å—Å—è —É –≤–∏–≥–ª—è–¥—ñ —Å–∏—Å—Ç–µ–º–∏ –¥–≤–æ—Ö —Ä—ñ–≤–Ω—è–Ω—å – –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ —Ä—ñ–≤–Ω—è–Ω–Ω—è —ñ —ñ–æ–Ω–Ω–æ–≥–æ —Ä—ñ–≤–Ω—è–Ω–Ω—è. –î–ª—è —Å–∫–ª–∞–¥–∞–Ω–Ω—è —Ä—ñ–≤–Ω—è–Ω—å —ñ–æ–Ω–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π –Ω–µ–æ–±—Ö—ñ–¥–Ω–æ –∑–Ω–∞—Ç–∏ —Ä—ñ–≤–Ω—è–Ω–Ω—è –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤ —ñ –ø—Ä–æ–¥—É–∫—Ç—ñ–≤.
–Ø–∫ —ñ –≤ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∏—Ö —Ä—ñ–≤–Ω—è–Ω–Ω—è—Ö, –≤ —ñ–æ–Ω–Ω–∏—Ö —Ä—ñ–≤–Ω—è–Ω–Ω—è—Ö –∑–ª—ñ–≤–∞ –∑–∞–ø–∏—Å—É—é—Ç—å —Ñ–æ—Ä–º—É–ª–∏ —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤, –∞ –ø—Ä–∞–≤–æ—Ä—É—á – —Ñ–æ—Ä–º—É–ª–∏ –ø—Ä–æ–¥—É–∫—Ç—ñ–≤, –∑–∞–∑–Ω–∞—á–µ–Ω—ñ —É –≤–∏–≥–ª—è–¥—ñ –æ–∫—Ä–µ–º–∏—Ö —ñ–æ–Ω—ñ–≤. –§–æ—Ä–º—É–ª–∏ —Å–ª–∞–±–∫–∏—Ö –ø–æ—Ç–µ–Ω—Ü—ñ–π–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤, –≤ —Ç–æ–º—É —á–∏—Å–ª—ñ —ñ –≤–æ–¥–∏, –∞ —Ç–∞–∫–æ–∂ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–∏—Ö —ñ —Ç–≤–µ—Ä–¥–∏—Ö —Ä–µ—á–æ–≤–∏–Ω (—è–∫—ñ –≤–∏–≤–æ–¥—è—Ç—å—Å—è –∑ –≤–æ–¥–Ω–æ–≥–æ —Ä–æ–∑—á–∏–Ω—É —É –≤–∏–≥–ª—è–¥—ñ –≥–∞–∑—É –∞–±–æ –æ—Å–∞–¥—É) –∑–∞–ª–∏—à–∞—é—Ç—å –≤ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–º—É –≤–∏–≥–ª—è–¥—ñ.
–ü—Ä–∏–∫–ª–∞–¥. –í —Ä–µ–∞–∫—Ü—ñ—ó –æ–±–º—ñ–Ω—É —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ, –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è
Na2CO3 + 2HCl = 2NaCl + CO2 (–≥–∞–∑) + H2O
–±–µ—Ä—É—Ç—å —É—á–∞—Å—Ç—å Na2CO3 (—Å—ñ–ª—å) HCl (–∫–∏—Å–ª–æ—Ç–∞) —ñ NaCl (—Å—ñ–ª—å) – —Å–∏–ª—å–Ω—ñ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏, CO2 –≥–∞–∑, –∑–∞–ª–∏—à–∞—î —Ä–µ–∞–∫—Ü—ñ–π–Ω—É —Å–∏—Å—Ç–µ–º—É, H2O – —Å–ª–∞–±–∫–∏–π –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç.
–ü–æ–≤–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó – —Ü–µ —Ñ–æ—Ä–º—É–ª–∏ –≤—Å—ñ—Ö —Å–∏–ª—å–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —É –≤–∏–≥–ª—è–¥—ñ —Å—É–º–∏ —ñ–æ–Ω—ñ–≤ –∑ —è–∫–∏—Ö –≤–æ–Ω–∏ —Å–∫–ª–∞–¥–µ–Ω—ñ, —ñ —Ñ–æ—Ä–º—É–ª–∏ –≥–∞–∑—ñ–≤, –≤–æ–¥–∏, –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —ñ –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –∑–∞–ø–∏—Å–∞–Ω–∏—Ö –≤ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–º—É –≤–∏–≥–ª—è–¥—ñ
2Na+ + CO32- + 2H+ + 2Cl– = 2Na+ + 2Cl– + CO2 + H2O
–Ü–æ–Ω–∏ Na‚Äã‚Äã+ —Ç–∞ Cl– –≤ –æ–¥–Ω–∞–∫–æ–≤—ñ–π –∫—ñ–ª—å–∫–æ—Å—Ç—ñ –ø—Ä–∏—Å—É—Ç–Ω—ñ —è–∫ –∑–ª—ñ–≤–∞ —Ç–∞–∫ —ñ —Å–ø—Ä–∞–≤–∞ –≤ —Ä—ñ–≤–Ω—è–Ω–Ω—ñ —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó, –æ—á–µ–≤–∏–¥–Ω–æ, —â–æ —Ü—ñ —ñ–æ–Ω–∏ –Ω–µ –±–µ—Ä—É—Ç—å —É—á–∞—Å—Ç—ñ –≤ —Ö—ñ–º—ñ—á–Ω—ñ–π —Ä–µ–∞–∫—Ü—ñ—ó.
–°–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó – —Ü–µ —Ñ–æ—Ä–º—É–ª–∏ —Å–∏–ª—å–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —É –≤–∏–≥–ª—è–¥—ñ —Å—É–º–∏ —ñ–æ–Ω—ñ–≤ –∑ —è–∫–∏—Ö –≤–æ–Ω–∏ —Å–∫–ª–∞–¥–µ–Ω—ñ, —ñ —Ñ–æ—Ä–º—É–ª–∏ –≥–∞–∑—ñ–≤, –≤–æ–¥–∏, –Ω–µ–µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ —ñ –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –∑–∞–ø–∏—Å–∞–Ω–∏—Ö –≤ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–º—É –≤–∏–≥–ª—è–¥—ñ, –∞–ª–µ –ª–∏—à–µ —Ç–∏—Ö, —è–∫—ñ –±–µ—Ä—É—Ç—å —É—á–∞—Å—Ç—å –≤ —Ö—ñ–º—ñ—á–Ω—ñ–π —Ä–µ–∞–∫—Ü—ñ—ó
CO32- + 2H+ = CO2 + H2O
–°–∫–æ—Ä–æ—á–µ–Ω—ñ —ñ–æ–Ω–Ω—ñ —Ä—ñ–≤–Ω—è–Ω–Ω—è –≤—ñ–¥–æ–±—Ä–∞–∂—É—é—Ç—å —Ö—ñ–º—ñ—á–Ω—É —Å—É—Ç–Ω—ñ—Å—Ç—å —Ä–µ–∞–∫—Ü—ñ–π –º—ñ–∂ —ñ–æ–Ω–∞–º–∏ (–≤ –¥–∞–Ω–æ–º—É –ø—Ä–∏–∫–ª–∞–¥—ñ – –º—ñ–∂ –∫–∞—Ä–±–æ–Ω–∞—Ç —ñ–æ–Ω–∞–º–∏ —ñ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É). –°—É–∫—É–ø–Ω–∏–π –∑–∞–ø–∏—Å –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ —ñ —Å–∫–æ—Ä–æ—á–µ–Ω–æ–≥–æ —ñ–æ–Ω–Ω–æ–≥–æ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –Ω–∞–æ—á–Ω–æ –≤—ñ–¥–æ–±—Ä–∞–∂–∞—î —Ö—ñ–º—ñ–∑–º —Ä–µ–∞–∫—Ü—ñ—ó. –û–¥–Ω–∞–∫ –æ–∫—Ä–µ–º–æ –∑–∞–ø–∏—Å–∞–Ω—ñ —Å–∫–æ—Ä–æ—á–µ–Ω—ñ —ñ–æ–Ω–Ω—ñ —Ä—ñ–≤–Ω—è–Ω–Ω—è –≤—ñ–¥–æ–±—Ä–∞–∂–∞—é—Ç—å –Ω–µ –æ–¥–Ω—É —Ä–µ–∞–∫—Ü—ñ—é, –∞ –±–µ–∑–ª—ñ—á –ø–æ–¥—ñ–±–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π. –¢–∞–∫, –≤–∫–∞–∑–∞–Ω–µ –≤–∏—â–µ —Å–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –º—ñ–∂ Na2CO3 —ñ HCl –æ–∑–Ω–∞—á–∞—î, —â–æ —Ç–∞–∫ —Å–∞–º–æ —Ä–µ–∞–≥—É—é—Ç—å –º—ñ–∂ —Å–æ–±–æ—é –Ω–µ —Ç—ñ–ª—å–∫–∏ –∑–∞–∑–Ω–∞—á–µ–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏, –∞–ª–µ —ñ –±—É–¥—å-—è–∫—ñ —ñ–Ω—à—ñ –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω—ñ –∫–∞—Ä–±–æ–Ω–∞—Ç–∏ (—è–∫—ñ –¥–∏—Å–æ—Ü—ñ—é—é—Ç—å –∑ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º CO32-) —ñ –±—É–¥—å-—è–∫—ñ —ñ–Ω—à—ñ –∫–∏—Å–ª–æ—Ç–∏ (—è–∫—ñ –¥–∏—Å–æ—Ü—ñ—é—é—Ç—å –∑ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º H+).
–ü—Ä–∏–∫–ª–∞–¥:
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
Cs2CO3 + 2HNO3 = 2CsNO3 + CO2 + H2O
–î–ª—è –æ–±–æ—Ö —Ö—ñ–º—ñ—á–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π –≤ –Ω–∞–≤–µ–¥–µ–Ω–æ–º—É –ø—Ä–∏–∫–ª–∞–¥—ñ –ø—ñ–¥—Ö–æ–¥–∏—Ç—å —Å–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
CO32- + 2H+ = CO2 + H2O
–î–ª—è –∫–∞—Ä–±–æ–Ω–∞—Ç—ñ–≤, –º–∞–ª–æ —Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —É –≤–æ–¥—ñ (–Ω–∞–ø—Ä–∏–∫–ª–∞–¥ CaCO3) —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –±—É–¥–µ —ñ–Ω—à–∏–º.
–ú–æ–ª–µ–∫—É–ª—è—Ä–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
–ü–æ–≤–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
CaCO3 + 2H+ + 2Cl– = Ca2+ + 2Cl– + CO2 + H2O
–°–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
–ê–Ω–∞–ª–æ–≥—ñ—á–Ω–æ –∑–∞–ø–∏—Å—É—é—Ç—å—Å—è —Ä–µ–∞–∫—Ü—ñ—ó –∑ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º –æ—Å–∞–¥—ñ–≤.
–ü—Ä–∏–∫–ª–∞–¥.
–ú–æ–ª–µ–∫—É–ª—è—Ä–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó:
CaCl2 + 2NaF = 2NaCl + CaF2
–ü–æ–≤–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
Ca2+ + 2Cl– + 2Na+ + 2F– = 2Na+ + 2Cl– + CaF2
–°–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
Ca2+ + 2F– = CaF2
–Ü–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ü—ñ—î—ó —Ä–µ–∞–∫—Ü—ñ—ó –≤—ñ–¥–Ω–æ—Å–∏—Ç—å—Å—è –Ω–µ —Ç—ñ–ª—å–∫–∏ –¥–æ –∫–æ–Ω–∫—Ä–µ—Ç–Ω–∏—Ö —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤ (CaCl2 —ñ NaF), –∞–ª–µ —ñ –¥–æ –≤—Å—ñ—Ö –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Å–æ–ª–µ–π –∫–∞–ª—å—Ü—ñ—é —ñ —Ñ–ª—É–æ—Ä–∏–¥—ñ–≤:
Ca(NO3)2 + 2KF = 2KNO3 + CaF2
Ca(ClO4)2 + 2NH4F = 2NH4ClO4 + CaF2
–Ý–µ–∞–∫—Ü—ñ—ó –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó
–í—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ –¥–æ —Ç–µ–æ—Ä—ñ—ó –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ—ó –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó
–Ý–µ–∞–∫—Ü—ñ—è –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó – —Ü–µ –≤–∑–∞—î–º–æ–¥—ñ—è –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É —ñ –≥—ñ–¥—Ä–æ–∫—Å–∏–¥-—ñ–æ–Ω—ñ–≤ –∑ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º –º–æ–ª–µ–∫—É–ª–∏ –≤–æ–¥–∏
–ö–∞—Ç—ñ–æ–Ω –≥—ñ–¥—Ä–æ–≥–µ–Ω—É + –ì—ñ–¥—Ä–æ–∫—Å–∏–¥-—ñ–æ–Ω ‚Üí –í–æ–¥–∞
H+ + OH– ‚Üí H2O
–ó —É—Ä–∞—Ö—É–≤–∞–Ω–Ω—è–º, —â–æ –∫–∞—Ç—ñ–æ–Ω–∏ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ —É –≤–∏–≥–ª—è–¥—ñ —ñ–æ–Ω—ñ–≤ H3O+, —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó –∑–∞–ø–∏—Å—É—î—Ç—å—Å—è –≤ –∑–∞–≥–∞–ª—å–Ω–æ–º—É –≤–∏–≥–ª—è–¥—ñ —Ç–∞–∫:
–ö–∞—Ç—ñ–æ–Ω –æ–∫—Å–æ–Ω—ñ—é + –ì—ñ–¥—Ä–æ–∫—Å–∏–¥-—ñ–æ–Ω ‚Üí –í–æ–¥–∞
H3O+ + OH– ‚Üí 2H2O
–Ý–µ–∞–∫—Ü—ñ—ó –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó —î –æ–¥–Ω–æ—á–∞—Å–Ω–æ —ñ —Ä–µ–∞–∫—Ü—ñ—è–º–∏ —Å–æ–ª–µ—É—Ç–≤–æ—Ä–µ–Ω–Ω—è. –í —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –≤–∑–∞—î–º–æ–¥—ñ—ó —Å–∏–ª—å–Ω–∏—Ö –æ—Å–Ω–æ–≤ –∑ —Å–∏–ª—å–Ω–∏–º–∏ –∫–∏—Å–ª–æ—Ç–∞–º–∏ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è —Ä–æ–∑—á–∏–Ω —Å–æ–ª—ñ, —è–∫–∏–π –º–∞—î –Ω–µ–π—Ç—Ä–∞–ª—å–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH = 7).
–ü—Ä–∏–∫–ª–∞–¥–∏.
–ú–æ–ª–µ–∫—É–ª—è—Ä–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
–ü–æ–≤–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
Ca2+ + 2OH– + 2H+ + 2NO3– = Ca2+ + 2NO3– + 2H2O
–°–∫–æ—Ä–æ—á–µ–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è:
H+ + OH– = H2O
–ë—ñ–ª—å—à —Å—É—á–∞—Å–Ω–µ –ø–æ—è—Å–Ω–µ–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ–π –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó –¥–∞—î –ü—Ä–æ—Ç–æ–Ω–∞ —Ç–µ–æ—Ä—ñ—è –ë—Ä–µ–Ω—Å—Ç–µ–¥–∞.
–ì—ñ–¥—Ä–æ–ª—ñ–∑ (—â–æ —Ç–∞–∫–µ –≥—ñ–¥—Ä–æ–ª—ñ–∑)
–Ý–æ–∑—á–∏–Ω–∏ —Å–æ–ª–µ–π, —É—Ç–≤–æ—Ä–µ–Ω–∏—Ö –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–∏—Ö –æ—Å–Ω–æ–≤ –∞–±–æ –∞–Ω—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–∏—Ö –∫–∏—Å–ª–æ—Ç, –º–∞—é—Ç—å –∞–±–æ –∫–∏—Å–ª–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH < 7), –∞–±–æ –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH > 7). –ó –ø–æ–≥–ª—è–¥—É —ñ–æ–Ω–Ω–æ—ó —Ç–µ–æ—Ä—ñ—ó –ê—Ä—Ä–µ–Ω—ñ—É—Å–∞ —Ü–µ –ø–æ—è—Å–Ω—é—î—Ç—å—Å—è —Ç–∏–º, —â–æ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è —Ä–µ–∞–∫—Ü—ñ—è –≥—ñ–¥—Ä–æ–ª—ñ–∑—É. –£ –∑–∞–≥–∞–ª—å–Ω–æ–º—É –≤–∏–ø–∞–¥–∫—É –≥—ñ–¥—Ä–æ–ª—ñ–∑ –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è —è–∫ –≤–∑–∞—î–º–æ–¥—ñ—è —Å–æ–ª—ñ –∑ –≤–æ–¥–æ—é:
–°—ñ–ª—å + –í–æ–¥–∞ ‚Üí –ö–∏—Å–ª–æ—Ç–∞ + –û—Å–Ω–æ–≤–∞
–ì—ñ–¥—Ä–æ–ª—ñ–∑ – —Ü–µ —Ö—ñ–º—ñ—á–Ω–∞ —Ä–µ–∞–∫—Ü—ñ—è, –∑–≤–æ—Ä–æ—Ç–Ω–∞ –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó, –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ —è–∫–æ—ó –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∫–∏—Å–ª–æ—Ç–∏ —ñ –æ—Å–Ω–æ–≤–∏
Кислота + Основа ⇄ Сіль + Вода
–ú–æ–∂–ª–∏–≤—ñ—Å—Ç—å —ñ —Ö–∞—Ä–∞–∫—Ç–µ—Ä –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è –ø—Ä–∏—Ä–æ–¥–æ—é —Å–æ–ª—ñ, —Ç–æ–±—Ç–æ –ø—Ä–∏—Ä–æ–¥–æ—é –∫–∏—Å–ª–æ—Ç–∏ —ñ –æ—Å–Ω–æ–≤–∏, –∑ —è–∫–∏—Ö —É—Ç–≤–æ—Ä–µ–Ω–∞ —Å—ñ–ª—å.
- –°–æ–ª—ñ, —É—Ç–≤–æ—Ä–µ–Ω—ñ —Å–∏–ª—å–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é —ñ —Å–∏–ª—å–Ω–æ—é –æ—Å–Ω–æ–≤–æ—é, –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –Ω–µ –ø—ñ–¥–¥–∞—é—Ç—å—Å—è, —ó—Ö –≤–æ–¥–Ω—ñ —Ä–æ–∑—á–∏–Ω–∏ –º–∞—é—Ç—å –Ω–µ–π—Ç—Ä–∞–ª—å–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (–Ω–∞–ø—Ä–∏–∫–ª–∞–¥, NaCl, K2SO4, NaNO3). –î–∏–≤. –ü—Ä–∏–∫–ª–∞–¥ 1.
- –í–æ–¥–Ω—ñ —Ä–æ–∑—á–∏–Ω–∏ —Å–æ–ª–µ–π, —â–æ —É—Ç–≤–æ—Ä–µ–Ω—ñ –∞–Ω—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–∏—Ö –∫–∏—Å–ª–æ—Ç —ñ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ —Å–∏–ª—å–Ω–∏—Ö –æ—Å–Ω–æ–≤, –º–∞—é—Ç—å –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (–Ω–∞–ø—Ä–∏–∫–ª–∞–¥, Na2CO3, KNO2, CH3COONa). –î–∏–≤. –ü—Ä–∏–∫–ª–∞–¥ 2.
- –í–æ–¥–Ω—ñ —Ä–æ–∑—á–∏–Ω–∏ —Å–æ–ª–µ–π, —â–æ —É—Ç–≤–æ—Ä–µ–Ω—ñ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–∏—Ö –æ—Å–Ω–æ–≤ —ñ –∞–Ω—ñ–æ–Ω–∞–º–∏ —Å–∏–ª—å–Ω–∏—Ö –∫–∏—Å–ª–æ—Ç, –º–∞—é—Ç—å –∫–∏—Å–ª–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (–Ω–∞–ø—Ä–∏–∫–ª–∞–¥, NH4NO3, FeCl3). –î–∏–≤. –ü—Ä–∏–∫–ª–∞–¥ 3.
- –î–ª—è –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Å–æ–ª–µ–π, —É—Ç–≤–æ—Ä–µ–Ω–∏—Ö –∞–Ω—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–æ—ó –∫–∏—Å–ª–æ—Ç–∏ —ñ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ —Å–ª–∞–±–∫–æ—ó –æ—Å–Ω–æ–≤–∏, —Ä–µ–∞–∫—Ü—ñ—è —Ä–æ–∑—á–∏–Ω—ñ–≤ –∑–∞–ª–µ–∂–∏—Ç—å –≤—ñ–¥ —Å—Ç—É–ø–µ–Ω—ñ –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è –æ–±–æ—Ä–æ—Ç–Ω–∏—Ö —Å—Ç–∞–¥—ñ–π –≤–∑–∞—î–º–æ–¥—ñ—ó –∑ –≤–æ–¥–æ—é. –¢–æ–±—Ç–æ –≤—ñ–¥ —Ç–æ–≥–æ, —â–æ —î –±—ñ–ª—å—à —Å–∏–ª—å–Ω–∏–º –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–æ–º, –∫–∏—Å–ª–æ—Ç–∞ —á–∏ –æ—Å–Ω–æ–≤–∞, —è–∫—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å —Å—ñ–ª—å. –î–∏–≤. –ü—Ä–∏–∫–ª–∞–¥ 4.
–ü—Ä–∏–∫–ª–∞–¥ 1.
–ì—ñ–¥—Ä–æ–ª—ñ–∑ —Å–æ–ª–µ–π —Å–∏–ª—å–Ω–∏—Ö –∫–∏—Å–ª–æ—Ç —ñ —Å–∏–ª—å–Ω–∏—Ö –æ—Å–Ω–æ–≤ –≤—ñ–¥—Å—É—Ç–Ω—ñ–π. –í—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—è —Å–æ–ª—ñ —ñ –ø—Ä–æ—Ü–µ—Å –≥—ñ–¥—Ä–∞—Ç–∞—Ü—ñ—ó —ñ–æ–Ω—ñ–≤:
K2SO4 + nmH2O = 2K+*nH2O + SO42-*mH2O
–ü—Ä–∏–∫–ª–∞–¥ 2.
–ù–∞—Ç—Ä—ñ–π –Ω—ñ—Ç—Ä–∏—Ç NaNO2 – —Å—ñ–ª—å —Å–∏–ª—å–Ω–æ—ó –æ—Å–Ω–æ–≤–∏ NaOH —ñ —Å–ª–∞–±–∫–æ—ó –∫–∏—Å–ª–æ—Ç–∏ HNO2. –°—ñ–ª—å NaNO2 –¥–∏—Å–æ—Ü—ñ—é—î —É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –Ω–∞ –∫–∞—Ç—ñ–æ–Ω–∏ –Ω–∞—Ç—Ä—ñ—é —ñ –Ω—ñ—Ç—Ä–∏—Ç-—ñ–æ–Ω–∏, –∞ –Ω–∞ –Ω–∞—Å—Ç—É–ø–Ω—ñ–π —Å—Ç–∞–¥—ñ—ó –Ω—ñ—Ç—Ä–∏—Ç-—ñ–æ–Ω–∏ –∑–≤–æ—Ä–æ—Ç–Ω–æ —Ä–µ–∞–≥—É—é—Ç—å –∑ –≤–æ–¥–æ—é:
NaNO2 = Na+ + NO2–
NO2– + H2O ‚áÑ HNO2 + OH–
–í —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –Ω–∞—Ç—Ä—ñ–π –Ω—ñ—Ç—Ä–∏—Ç—É —Ä–æ–∑—á–∏–Ω —Ü—ñ—î—ó —Å–æ–ª—ñ –º–∞—î –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH > 7).
–Ø–∫—â–æ —Å—ñ–ª—å —É—Ç–≤–æ—Ä–µ–Ω–∞ –∞–Ω–∏–æ–Ω–∞–º–∏ –±–∞–≥–∞—Ç–æ–æ—Å–Ω–æ–≤–Ω–æ—ó —Å–ª–∞–±–∫–æ—ó –∫–∏—Å–ª–æ—Ç–∏, —Ç–æ –ø—Ä–æ–¥—É–∫—Ç–æ–º —Ä–µ–∞–∫—Ü—ñ—ó –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –±—É–¥–µ –≥—ñ–¥—Ä–æ–∞–Ω—ñ–æ–Ω – –∞–Ω—ñ–æ–Ω –∫–∏—Å–ª–æ—Ç–Ω–æ–≥–æ –∑–∞–ª–∏—à–∫—É, —â–æ –º—ñ—Å—Ç–∏—Ç—å –≥—ñ–¥—Ä–æ–≥–µ–Ω.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥, –≥—ñ–¥—Ä–æ–ª—ñ–∑ –Ω–∞—Ç—Ä—ñ–π –∫–∞—Ä–±–æ–Ω–∞—Ç—É –æ–ø–∏—Å—É—î—Ç—å—Å—è –Ω–∞—Å—Ç—É–ø–Ω–∏–º–∏ –¥–≤–æ–º–∞ —Å—Ç–∞–¥—ñ—è–º–∏:
Na2CO3 = 2Na+ + CO32-
CO32- + H2O ‚áÑ HCO3– + OH–
–°–ª—ñ–¥ –∑–≤–µ—Ä–Ω—É—Ç–∏ —É–≤–∞–≥—É –Ω–∞ –ø–æ—à–∏—Ä–µ–Ω—É –ø–æ–º–∏–ª–∫—É –ø—Ä–∏ —Å–∫–ª–∞–¥–∞–Ω–Ω—ñ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –≥—ñ–¥—Ä–æ–ª—ñ–∑—É.
–ù–µ –º–æ–∂–Ω–∞ –≤ —Ä—ñ–≤–Ω—è–Ω–Ω—ñ –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É–≤–∞—Ç–∏ –±—ñ–ª—å—à, –Ω—ñ–∂ –æ–¥–Ω—É –º–æ–ª–µ–∫—É–ª—É –≤–æ–¥–∏ – —Ü–µ –Ω–µ–ø—Ä–∞–≤–∏–ª—å–Ω–æ!
–ü—Ä–∞–≤–∏–ª—å–Ω–æ: CO32- + H2O ‚áÑ HCO3– + OH–
–ù–µ–ø—Ä–∞–≤–∏–ª—å–Ω–æ: CO32- + 2H2O ‚áÑ H2CO3 + 2OH–
–û—Å—Ç–∞–Ω–Ω—ñ–π –∑–∞–ø–∏—Å —î –ø–æ–º–∏–ª–∫–æ–≤–∏–º —Ç–æ–º—É, —â–æ –Ω–∞–∫–æ–ø–∏—á–µ–Ω–Ω—è –≤ —Ä–æ–∑—á–∏–Ω—ñ –≥—ñ–¥—Ä–æ–∫—Å–∏–¥-—ñ–æ–Ω—ñ–≤ OH- –æ–±–æ–≤’—è–∑–∫–æ–≤–æ –ø—Ä–∏–∑–≤–µ–¥–µ –¥–æ –∑–≤–æ—Ä–æ—Ç–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó – —á–∞—Å—Ç–∫–æ–≤–æ—ó –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó –∫–∞—Ä–±–æ–Ω–æ–≤–æ—ó –∫–∏—Å–ª–æ—Ç–∏:
H2CO3 + OH- = HCO3– + H2O
–¢–æ–º—É –¥—ñ–π—Å–Ω–∏–º –ø—Ä–æ–¥—É–∫—Ç–æ–º –≥—ñ–¥—Ä–æ–ª—ñ–∑—É —Ä–æ–∑—á–∏–Ω–Ω–∏—Ö –∫–∞—Ä–±–æ–Ω–∞—Ç—ñ–≤ (Na2CO3, K2CO3) —î –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç-—ñ–æ–Ω HCO3–, –∞ –Ω–µ –∫–∞—Ä–±–æ–Ω–æ–≤–∞ –∫–∏—Å–ª–æ—Ç–∞. –ü—Ä–∞–≤–∏–ª—å–Ω—ñ—Å—Ç—å —Ü—å–æ–≥–æ —Ç–≤–µ—Ä–¥–∂–µ–Ω–Ω—è –¥–æ–≤–æ–¥–∏—Ç—å –≤—ñ–¥—Å—É—Ç–Ω—ñ—Å—Ç—å –≤–∏–¥—ñ–ª–µ–Ω–Ω—è –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–≥–æ –∫–∞—Ä–±–æ–Ω(IV) –æ–∫—Å–∏–¥—É –∑ —Ä–æ–∑—á–∏–Ω—ñ–≤ –∫–∞—Ä–±–æ–Ω–∞—Ç—ñ–≤. –Ø–∫–±–∏ –≥—ñ–¥—Ä–æ–ª—ñ–∑ –ø—Ä–æ—Ç—ñ–∫–∞–≤ –¥–æ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –≤–µ–ª–∏–∫–∏—Ö –∫—ñ–ª—å–∫–æ—Å—Ç–µ–π –∫–∞—Ä–±–æ–Ω–æ–≤–æ—ó –∫–∏—Å–ª–æ—Ç–∏, —Ç–æ –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ —ó—ó –Ω–µ—Å—Ç—ñ–π–∫–æ—Å—Ç—ñ –ø—Ä–∏ –≤–µ–ª–∏–∫—ñ–π –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü—ñ—ó –≤ —Ä–æ–∑—á–∏–Ω—ñ –æ–±–æ–≤’—è–∑–∫–æ–≤–æ –± —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞–ª–æ—Å—è –≤–∏–¥—ñ–ª–µ–Ω–Ω—è –≥–∞–∑—É:
H2CO3 = H2O + CO2
–ü—Ä–∏–∫–ª–∞–¥ 3.
–©–µ –æ–¥–∏–Ω –ø—Ä–∏–∫–ª–∞–¥ —Å—Ç–æ—Å—É—î—Ç—å—Å—è –≥—ñ–¥—Ä–æ–ª—ñ–∑—É —Å–æ–ª—ñ —É—Ç–≤–æ—Ä–µ–Ω–æ—ó —Å–∏–ª—å–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é —ñ —Å–ª–∞–±–∫–æ—é –æ—Å–Ω–æ–≤–æ—é, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ –∞–º–æ–Ω—ñ–π –Ω—ñ—Ç—Ä–∞—Ç NH4NO3:
NH4NO3 = NH4+ + NO3–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
–í —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –≥—ñ–¥—Ä–æ–ª—ñ–∑—É —Ä–æ–∑—á–∏–Ω –∞–º–æ–Ω—ñ–π –Ω—ñ—Ç—Ä–∞—Ç—É –º–∞—î –∫–∏—Å–ª–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH < 7).
–Ø–∫—â–æ —Å—ñ–ª—å —É—Ç–≤–æ—Ä–µ–Ω–∞ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ –º–Ω–æ–≥–æ–æ—Å–Ω–æ–≤–Ω–∏—Ö –æ—Å–Ω–æ–≤, —Ç–æ –ø—Ä–æ–¥—É–∫—Ç–æ–º –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –±—É–¥–µ –≥—ñ–¥—Ä–æ–∫—Å–æ–∫–∞—Ç—ñ–æ–Ω –æ—Å–Ω–æ–≤–∏.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥, –≥—ñ–¥—Ä–æ–ª—ñ–∑ —Ñ–µ—Ä—É–º(II) —Å—É–ª—å—Ñ–∞—Ç—É –ø—Ä–æ—Ç—ñ–∫–∞—î –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ –¥–æ –Ω–∞—Å—Ç—É–ø–Ω–∏—Ö –¥–≤–æ—Ö —Å—Ç–∞–¥—ñ–π:
FeSO4 = Fe2+ + SO42-
Fe2+ + H2O ⇄ FeOHР+ H+; H+ + H2O = H3O+ (pH < 7)
–ù–µ–ø—Ä–∞–≤–∏–ª—å–Ω–∏–º –±—É–¥–µ —Ç–∞–∫–∏–π –∑–∞–ø–∏—Å —Ä–µ–∞–∫—Ü—ñ—ó –≥—ñ–¥—Ä–æ–ª—ñ–∑—É:
Fe2+ + 2H2O ⇄ Fe(OH)2 + 2H+
–Ø–∫–±–∏ –¥–∞–Ω–∞ —Ä–µ–∞–∫—Ü—ñ—è –≤—ñ–¥–±—É–ª–∞—Å—è, –º–∏ —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞–ª–∏ –± —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –æ—Å–∞–¥—É Fe(OH)2, –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ –π–æ–≥–æ –º–∞–ª–æ—ó —Ä–æ–∑—á–∏–Ω–Ω–æ—Å—Ç—ñ (5e-5 –≥. –≤ 100 –≥. H2O), –æ–¥–Ω–∞–∫ –æ—Å–∞–¥ –Ω–µ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è.
–ü—Ä–∏–∫–ª–∞–¥ 4.
–ì—ñ–¥—Ä–æ–ª—ñ–∑ –∞–º–æ–Ω—ñ–π –Ω—ñ—Ç—Ä–∏—Ç—É –ø—Ä–æ—Ç—ñ–∫–∞—î –∑–∞ —Ç–∞–∫–∏–º–∏ —Å—Ç–∞–¥—ñ—è–º–∏:
NH4NO2 = NH4+ + NO2–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
NO2– + H2O ‚áÑ HNO2 + OH–
–í—ñ–¥–æ–º–æ, —â–æ –≥—ñ–¥—Ä–æ–ª—ñ–∑ –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –∞–º–æ–Ω—ñ—é –ø—Ä–æ—Ç—ñ–∫–∞—î –±—ñ–ª—å—à –ø–æ–≤–Ω–æ, –æ—Ç–∂–µ, –±—ñ–ª—å—à–µ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –∫–∞—Ç—ñ–æ–Ω—ñ–≤ H+ (–≤ –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—ñ –∑ –∞–Ω—ñ–æ–Ω–∞–º–∏ OH–) —Ç–æ–º—É —Ä–æ–∑—á–∏–Ω –±—É–¥–µ —Å–ª–∞–±–æ–∫–∏—Å–ª–∏–º (pH < 7).
–ó–≤–µ—Ä–Ω—ñ—Ç—å —É–≤–∞–≥—É —ñ –ø–æ—Ä—ñ–≤–Ω—è–π—Ç–µ –∫–æ–Ω—Å—Ç–∞–Ω—Ç–∏ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó –∫–∏—Å–ª–æ—Ç —ñ –æ—Å–Ω–æ–≤, —è–∫–∏–º–∏ —É—Ç–≤–æ—Ä–µ–Ω–∞ —Å—ñ–ª—å. –ö–æ–Ω—Å—Ç–∞–Ω—Ç–∏ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏–∑—É—é—Ç—å —Å–∏–ª—É –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ – —è–∫–∏–π –∑ –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤, —â–æ —É—Ç–≤–æ—Ä—é—é—Ç—å —Å—ñ–ª—å, –±—ñ–ª—å—à —Å–∏–ª—å–Ω–∏–π, —Ç–æ–π —ñ –æ–±—É–º–æ–≤–ª—é—î –∫–∏—Å–ª–æ—Ç–Ω—ñ—Å—Ç—å —Å–µ—Ä–µ–¥–æ–≤–∏—â–∞:
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó NH3*H2O = 1,76e-5
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó HNO2 = 5,10e-4
–ì—ñ–¥—Ä–æ–ª—ñ–∑ –∞–º–æ–Ω—ñ–π –∞—Ü–µ—Ç–∞—Ç—É –ø—Ä–æ—Ç—ñ–∫–∞—î –∑–∞ —Ç–∞–∫–∏–º–∏ —Å—Ç–∞–¥—ñ—è–º–∏:
CH3COONH4 = NH4+ + CH3COO–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
CH3COO– + H2O ‚áÑ CH3COOH + OH–
–°—Ç—É–ø—ñ–Ω—å –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è –æ–±–æ—Ö –æ–±–æ—Ä–æ—Ç–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π –æ–¥–Ω–∞–∫–æ–≤–∞, —Ç–æ–º—É —Ä–æ–∑—á–∏–Ω –∞–º–æ–Ω—ñ–π –∞—Ü–µ—Ç–∞—Ç—É –º–∞—î –Ω–µ–π—Ç—Ä–∞–ª—å–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH = 7).
–ó–≤–µ—Ä–Ω—ñ—Ç—å —É–≤–∞–≥—É —ñ –ø–æ—Ä—ñ–≤–Ω—è–π—Ç–µ –∫–æ–Ω—Å—Ç–∞–Ω—Ç–∏ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó –∫–∏—Å–ª–æ—Ç —ñ –æ—Å–Ω–æ–≤, —è–∫–∏–º–∏ —É—Ç–≤–æ—Ä–µ–Ω–∞ —Å—ñ–ª—å:
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó NH3*H2O = 1,76e-5
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó CH3COOH = 1,74e-5
–Ý–æ–∑—á–∏–Ω –∞–º–æ–Ω—ñ–π —Ü—ñ–∞–Ω—ñ–¥—É –º–∞—î —Å–∏–ª—å–Ω–æ–ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH > 7) –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ –±—ñ–ª—å—à–æ—ó –º—ñ—Ä–∏ –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –≥—ñ–¥—Ä–æ–ª—ñ–∑—É —Ü—ñ–∞–Ω—ñ–¥-—ñ–æ–Ω–∞:
NH4CN = NH4+ + CN–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
CN– + H2O ‚áÑ HCN + OH–
–ó–≤–µ—Ä–Ω—ñ—Ç—å —É–≤–∞–≥—É —ñ –ø–æ—Ä—ñ–≤–Ω—è–π—Ç–µ –∫–æ–Ω—Å—Ç–∞–Ω—Ç–∏ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó –∫–∏—Å–ª–æ—Ç —ñ –æ—Å–Ω–æ–≤, —è–∫–∏–º–∏ —É—Ç–≤–æ—Ä–µ–Ω–∞ —Å—ñ–ª—å:
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó NH3*H2O = 1,76e-5
–ö–æ–Ω—Å—Ç–∞–Ω—Ç–∞ —ñ–æ–Ω—ñ–∑–∞—Ü—ñ—ó HCN = 5e-10
–£ –≤–æ–¥–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö –∫–∏—Å–ª–∏—Ö —Å–æ–ª–µ–π –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –æ–¥–Ω–æ—á–∞—Å–Ω–æ, –∞–ª–µ –≤ —Ä—ñ–∑–Ω–æ–º—É —Å—Ç—É–ø–µ–Ω—ñ –¥–≤—ñ –æ–±–æ—Ä–æ—Ç–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó – –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—è –≥—ñ–¥—Ä–æ–∞–Ω—ñ–æ–Ω–∞ —ñ –π–æ–≥–æ –≥—ñ–¥—Ä–æ–ª—ñ–∑, —Ä–µ–∑—É–ª—å—Ç–∞—Ç —Ü–∏—Ö –ø—Ä–æ—Ü–µ—Å—ñ–≤ —ñ –≤–∏–∑–Ω–∞—á–∞—î —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ —Ä–æ–∑—á–∏–Ω—É.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥, –≤–æ–¥–Ω–∏–π —Ä–æ–∑—á–∏–Ω –Ω–∞—Ç—Ä—ñ–π –≥—ñ–¥—Ä–æ—Å—É–ª—å—Ñ—ñ—Ç—É NaHSO3 –º–∞—î –∫–∏—Å–ª–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH < 7):
NaHSO3 = Na+ + HSO3–
HSO3Р⇄ H+ + SO32-; H+ + H2O = H3O+
HSO3– + H2O ‚áÑ SO2*H2O + OH–
–í–æ–¥–Ω–∏–π —Ä–æ–∑—á–∏–Ω –Ω–∞—Ç—Ä—ñ–π –≥—ñ–¥—Ä–æ–æ—Ä—Ç–æ—Ñ–æ—Å—Ñ–∞—Ç—É Na2HPO4 –º–∞—î –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ (pH > 7):
Na2HPO4 = 2Na+ + HPO42-
HPO42- ⇄ H+ + PO43-; H+ + H2O = H3O+
HPO42- + H2O ‚áÑ H2PO4– + OH–
–¢–æ–º—É –Ω–∞–∑–≤–∞ “–∫–∏—Å–ª—ñ —Å–æ–ª—ñ” –Ω–µ –ø–æ–≤–∏–Ω–Ω–∞ –≤–≤–æ–¥–∏—Ç–∏ –≤ –æ–º–∞–Ω—É, —â–æ —Ä–µ–∞–∫—Ü—ñ—è —Ä–æ–∑—á–∏–Ω—ñ–≤ —Ç–∞–∫–∏—Ö —Å–æ–ª–µ–π –∑–∞–≤–∂–¥–∏ –∫–∏—Å–ª–∞.
–û–±–æ—Ä–æ—Ç–Ω–∞ —Ä–µ–∞–∫—Ü—ñ—è –≥—ñ–¥—Ä–æ–ª—ñ–∑—É —Å–æ–ª—ñ –ø—Ä–æ—Ç—ñ–∫–∞—î —Ç–∏–º –ø–æ–≤–Ω—ñ—à–µ, —á–∏–º –±—ñ–ª—å—à —Å–ª–∞–±–∫–æ—é —î –∫–∏—Å–ª–æ—Ç–∞ —ñ/–∞–±–æ –æ—Å–Ω–æ–≤–∞, —è–∫—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å —Å—ñ–ª—å. –¢–∞–∫, –∑ –æ—Å–Ω–æ–≤–∏ —ñ –∫–∏—Å–ª–æ—Ç–∏, —â–æ —É—Ç–≤–æ—Ä—é—é—Ç—å –∞–º–æ–Ω—ñ–π —Ü—ñ–∞–Ω—ñ–¥ NH4CN, –±—ñ–ª—å—à —Å–ª–∞–±–∫–∏–º –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–æ–º —î –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ü—ñ–∞–Ω—ñ–¥, –Ω—ñ–∂ –≥—ñ–¥—Ä–∞—Ç –∞–º–æ–Ω—ñ–∞–∫—É. –û—Å–∫—ñ–ª—å–∫–∏ –∫–∏—Å–ª–æ—Ç–Ω—ñ—Å—Ç—å —Å–µ—Ä–µ–¥–æ–≤–∏—â–∞ —Ä–æ–∑—á–∏–Ω—É –æ–±—É–º–æ–≤–ª—é—î—Ç—å—Å—è –±—ñ–ª—å—à —Å–∏–ª—å–Ω–∏–º –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–æ–º, —Ç–æ —Ä–æ–∑—á–∏–Ω –∞–º–æ–Ω—ñ–π —Ü—ñ–∞–Ω—ñ–¥—É –ø–æ–≤–∏–Ω–µ–Ω –º–∞—Ç–∏ –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ.
–Ø–∫—â–æ —Å—ñ–ª—å —É—Ç–≤–æ—Ä–µ–Ω–∞ –±—ñ–ª—å—à —Å–∏–ª—å–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é (–≤ –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—ñ –∑ —Å–∏–ª–æ—é –æ—Å–Ω–æ–≤–∏), —Ç–æ —Ä–æ–∑—á–∏–Ω —Å–æ–ª—ñ –±—É–¥–µ –∫–∏—Å–ª–∏–º;
–Ø–∫—â–æ —Å—ñ–ª—å —É—Ç–≤–æ—Ä–µ–Ω–∞ –±—ñ–ª—å—à —Å–∏–ª—å–Ω–æ—é –æ—Å–Ω–æ–≤–æ—é (–≤ –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—ñ –∑ —Å–∏–ª–æ—é –∫–∏—Å–ª–æ—Ç–∏), —Ç–æ —Ä–æ–∑—á–∏–Ω –±—É–¥–µ –ª—É–∂–Ω–∏–º
–í —Ä–∞–º–∫–∞—Ö —ñ–æ–Ω–Ω–æ—ó —Ç–µ–æ—Ä—ñ—ó –ê—Ä—Ä–µ–Ω—ñ—É—Å–∞ –º–µ—Ö–∞–Ω—ñ–∑–º –ø—Ä–æ—Ç—ñ–∫–∞–Ω–Ω—è –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –º–æ–∂–Ω–∞ –ø–æ—è—Å–Ω–∏—Ç–∏ –Ω–∞—Å—Ç—É–ø–Ω–∏–º —á–∏–Ω–æ–º. –í–æ–¥–∞ –ø—ñ–¥–¥–∞—î—Ç—å—Å—è, —Ö–æ—á–∞ —ñ –≤ –¥—É–∂–µ –Ω–µ–∑–Ω–∞—á–Ω—ñ–π –º—ñ—Ä—ñ, –∞–≤—Ç–æ–¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó:
H2O ‚áÑ H+ + OH–
–Ø–∫—â–æ —É –≤–æ–¥—É (–ø—Ä–∏ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—ñ —Å–æ–ª–µ–π —ñ —ó—Ö –ø–æ–≤–Ω—ñ–π –¥–∏—Å–æ—Ü—ñ–∞—Ü—ñ—ó) –≤–≤–æ–¥—è—Ç—å—Å—è –∞–Ω—ñ–æ–Ω–∏, —è–∫—ñ –º–æ–∂—É—Ç—å —É—Ç–≤–æ—Ä—é–≤–∞—Ç–∏ –∑ –∫–∞—Ç—ñ–æ–Ω–∞–º–∏ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É –º–∞–ª–æ–¥–∏—Å–æ—Ü—ñ—é—é—á—ñ –º–æ–ª–µ–∫—É–ª–∏ –∞–±–æ —ñ–æ–Ω–∏, —Ç–æ –¥–µ—è–∫–∞ –∫—ñ–ª—å–∫—ñ—Å—Ç—å —ñ–æ–Ω—ñ–≤ H+ –≤–∏—è–≤–ª—è—î—Ç—å—Å—è –∑–≤’—è–∑–∞–Ω–æ—é, –∞ —Ç–∞–∫–∞ —Å–∞–º–æ –∫—ñ–ª—å–∫—ñ—Å—Ç—å —ñ–æ–Ω—ñ–≤ OH– –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è –≤—ñ–ª—å–Ω–æ—é, –æ–±—É–º–æ–≤–ª—é—é—á–∏ –ª—É–∂–Ω–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ —Ä–æ–∑—á–∏–Ω—É (—Å–∏–ª—å–Ω–∞ –æ—Å–Ω–æ–≤–∞ + —Å–ª–∞–±–∫–∞ –∫–∏—Å–ª–æ—Ç–∞ = —Å—ñ–ª—å). –ù–∞–≤–ø–∞–∫–∏, —è–∫—â–æ –∫–∞—Ç—ñ–æ–Ω–∏ —Å–æ–ª—ñ –∑–≤’—è–∑—É—é—Ç—å –ø–µ–≤–Ω—É –∫—ñ–ª—å–∫—ñ—Å—Ç—å —ñ–æ–Ω—ñ–≤ OH–, —Ç–æ —Ç–∞–∫–∞ —Å–∞–º–∞ –∫—ñ–ª—å–∫—ñ—Å—Ç—å —ñ–æ–Ω—ñ–≤ H+ –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è –≤—ñ–ª—å–Ω–æ—é, –æ–±—É–º–æ–≤–ª—é—é—á–∏ –∫–∏—Å–ª–µ —Å–µ—Ä–µ–¥–æ–≤–∏—â–µ —Ä–æ–∑—á–∏–Ω—É (—Å–ª–∞–±–∫–∞ –æ—Å–Ω–æ–≤–∞ + —Å–∏–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ = —Å—ñ–ª—å).
Na2S = 2Na+ + S2-; H2O ‚áÑ H+ + OH–
H+ + S2- ‚áÑ HS–; pH > 7
Fe(NO3)3 = Fe3+ + 3NO3–; H2O ‚áÑ H+ + OH–
Fe3+ + OHР⇄ FeOH2+; pH < 7
–Ý–µ–∞–∫—Ü—ñ—ó –æ—Å–∞–¥–∂–µ–Ω–Ω—è
–ï–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏ (–∫–∏—Å–ª–æ—Ç–∏, –æ—Å–Ω–æ–≤–∏, —Å–æ–ª—ñ) –º–∞—é—Ç—å —Ä—ñ–∑–Ω—É —Ä–æ–∑—á–∏–Ω–Ω—ñ—Å—Ç—å –≤ –≤–æ–¥—ñ. –ü—Ä–∏ –∑–º—ñ—à—É–≤–∞–Ω–Ω—ñ —Ä–æ–∑—á–∏–Ω—ñ–≤ –¥–≤–æ—Ö –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç—ñ–≤ –º–æ–∂–ª–∏–≤–µ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –º–∞–ª–æ—Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, —â–æ —É—Ç–≤–æ—Ä—é—é—Ç—å –æ—Å–∞–¥–∏ —É —Ä–æ–∑—á–∏–Ω—ñ.
–Ý–µ–∞–∫—Ü—ñ—ó –æ—Å–∞–¥–∂–µ–Ω–Ω—è – —Ü–µ —ñ–æ–Ω–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó, —â–æ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å –∑ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è–º –º–∞–ª–æ—Ä–æ–∑—á–∏–Ω–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω
–ß–∏–º –Ω–∏–∂—á–µ —Ä–æ–∑—á–∏–Ω–Ω—ñ—Å—Ç—å —Ä–µ—á–æ–≤–∏–Ω–∏ —â–æ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è, —Ç–∏–º –º–µ–Ω—à–µ –≤—ñ–ª—å–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ —Ü—ñ—î—ó —Ä–µ—á–æ–≤–∏–Ω–∏ –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è –≤ —Ä–æ–∑—á–∏–Ω—ñ, –∞ –æ—Ç–∂–µ, –≤ –±—ñ–ª—å—à—ñ–π –º—ñ—Ä—ñ —Ä–µ–∞–∫—Ü—ñ—è –Ω–∞–±–ª–∏–∂–∞—î—Ç—å—Å—è –¥–æ –Ω–µ–∑–≤–æ—Ä–æ—Ç–Ω–æ—ó.
–ü—Ä–∏–∫–ª–∞–¥.
AgNO3 + NaCl = NaNO3 + AgCl‚Üì
Ag+ + Cl– = AgCl
–Ý–æ–∑—á–∏–Ω–Ω—ñ—Å—Ç—å –∞—Ä“ë–µ–Ω—Ç—É–º(I) —Ö–ª–æ—Ä–∏–¥—É —Å—Ç–∞–Ω–æ–≤–∏—Ç—å 1e-5 –º–æ–ª—å/–¥–º3. –û—Ç–∂–µ, –ø—ñ—Å–ª—è –∑–º—ñ—à—É–≤–∞–Ω–Ω—è, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ 0,01 —Ä–æ–∑—á–∏–Ω—ñ–≤ –∞—Ä–≥–µ–Ω—Ç—É–º(I) –Ω—ñ—Ç—Ä–∞—Ç—É —ñ –Ω–∞—Ç—Ä—ñ–π —Ö–ª–æ—Ä–∏–¥—É, –≤ –∫—ñ–Ω—Ü–µ–≤–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ –∑–∞–ª–∏—à–∫–æ–≤–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü—ñ—è —ñ–æ–Ω—ñ–≤ Ag+ —ñ Cl– –Ω–∞–¥–∑–≤–∏—á–∞–π–Ω–æ –Ω–∏–∑—å–∫–∞, –æ—Å–∫—ñ–ª—å–∫–∏ –æ—Å–Ω–æ–≤–Ω–∞ –∫—ñ–ª—å–∫—ñ—Å—Ç—å —Ü–∏—Ö —ñ–æ–Ω—ñ–≤ –ø–µ—Ä–µ—Ö–æ–¥–∏—Ç—å –≤ –æ—Å–∞–¥ AgCl.
–ê—Ä“ë–µ–Ω—Ç—É–º(I) —Ö–ª–æ—Ä–∏–¥ AgCl –º–æ–∂–Ω–∞ –æ—Ç—Ä–∏–º–∞—Ç–∏ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—é—á–∏ —ñ —ñ–Ω—à—ñ –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω—ñ —Ä–µ–∞–≥–µ–Ω—Ç–∏:
2AgClO4 + BaCl2 = 2AgCl + Ba(ClO4)2
AgNO3 + HCl = HNO3 + AgCl
–ü—Ä–∏ –≤–∏–±–æ—Ä—ñ —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤ –¥–ª—è –ø—Ä–æ–≤–µ–¥–µ–Ω–Ω—è —Ä–µ–∞–∫—Ü—ñ—ó –æ—Å–∞–¥–∂–µ–Ω–Ω—è —Å–ª—ñ–¥ –≤—Ä–∞—Ö–æ–≤—É–≤–∞—Ç–∏, —â–æ —ñ –¥—Ä—É–≥–∏–π –ø—Ä–æ–¥—É–∫—Ç —Ä–µ–∞–∫—Ü—ñ—ó –º–æ–∂–µ –≤–∏—è–≤–∏—Ç–∏—Å—è –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–∏–º. –ù–∞–ø—Ä–∏–∫–ª–∞–¥:
2AgF + CaCl2 = 2AgCl‚Üì + CaF2‚Üì
–ó–∞—É–≤–∞–∂—Ç–µ, –¥–ª—è –¥–∞–Ω–æ—ó —Ö—ñ–º—ñ—á–Ω–æ—ó —Ä–µ–∞–∫—Ü—ñ—ó –ø–æ–≤–Ω–µ —ñ–æ–Ω–Ω–µ —Ä—ñ–≤–Ω—è–Ω–Ω—è —Ü—ñ—î—ó —Ä–µ–∞–∫—Ü—ñ—ó —Å–∫–æ—Ä–æ—á–µ–Ω–Ω—é –Ω–µ –ø—ñ–¥–¥–∞—î—Ç—å—Å—è, —Ç–æ–º—É —â–æ –≤—Å—ñ —ñ–æ–Ω–∏ —É—Ç–≤–æ—Ä—é—é—Ç—å –º–∞–ª–æ—Ä–æ–∑—á–∏–Ω–Ω—ñ –ø—Ä–æ–¥—É–∫—Ç–∏
2Ag+ + 2F– + Ca2+ + 2Cl– = 2AgCl + CaF2
–í –∞–Ω–∞–ª—ñ—Ç–∏—á–Ω—ñ–π —Ö—ñ–º—ñ—ó —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –æ—Å–∞–¥—É AgCl —á–∞—Å—Ç–æ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –¥–ª—è –≤–∏—è–≤–ª–µ–Ω–Ω—è —è–∫ –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –∞—Ä–≥–µ–Ω—Ç—É–º(I), —Ç–∞–∫ —ñ —Ö–ª–æ—Ä–∏–¥ —ñ–æ–Ω—ñ–≤. –ü—Ä–∏ –∞–Ω–∞–ª—ñ–∑—ñ —Ä–æ–∑—á–∏–Ω—É –Ω–∞ –ø—Ä–∏—Å—É—Ç–Ω—ñ—Å—Ç—å –∫–∞—Ç—ñ–æ–Ω—ñ–≤ Ag+ –¥–æ –Ω—å–æ–≥–æ –¥–æ–¥–∞—é—Ç—å –∫—ñ–ª—å–∫–∞ –∫—Ä–∞–ø–µ–ª—å —Ä–æ–∑–≤–µ–¥–µ–Ω–æ–≥–æ HCl –∞–±–æ NaCl; —è–∫—â–æ —Ä–æ–∑—á–∏–Ω –ø–µ—Ä–µ–≤—ñ—Ä—è—é—Ç—å –Ω–∞ –ø—Ä–∏—Å—É—Ç–Ω—ñ—Å—Ç—å Cl–, —Ç–æ –¥–æ –Ω—å–æ–≥–æ –¥–æ–¥–∞—é—Ç—å –∫—ñ–ª—å–∫–∞ –∫—Ä–∞–ø–µ–ª—å —Ä–æ–∑–≤–µ–¥–µ–Ω–æ–≥–æ —Ä–æ–∑—á–∏–Ω—É AgNO3.
–©–µ –æ–¥–Ω—ñ—î—é –ø–æ—à–∏—Ä–µ–Ω–æ—é —è–∫—ñ—Å–Ω–æ—é —Ä–µ–∞–∫—Ü—ñ—î—é –≤ –∞–Ω–∞–ª—ñ—Ç–∏—á–Ω—ñ–π —Ö—ñ–º—ñ—ó —î —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –ø—Ä–∞–∫—Ç–∏—á–Ω–æ –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–æ–≥–æ –±–∞—Ä—ñ–π —Å—É–ª—å—Ñ–∞—Ç—É BaSO4:
Ba2+ + SO42- = BaSO4
–¶—é —Ä–µ–∞–∫—Ü—ñ—é –º–æ–∂–Ω–∞ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É–≤–∞—Ç–∏ —è–∫ –¥–ª—è —è–∫—ñ—Å–Ω–æ–≥–æ —Ç–∞–∫ —ñ –¥–ª—è –∫—ñ–ª—å–∫—ñ—Å–Ω–æ–≥–æ –≤–∏–∑–Ω–∞—á–µ–Ω–Ω—è –∫–∞—Ç—ñ–æ–Ω—ñ–≤ –±–∞—Ä—ñ—é –∞–±–æ —Å—É–ª—å—Ñ–∞—Ç-—ñ–æ–Ω—ñ–≤ –≤ —Ä–æ–∑—á–∏–Ω—ñ.
–Ý–µ–∞–≥–µ–Ω—Ç–∏ –¥–ª—è —Ä–µ–∞–∫—Ü—ñ–π –æ—Å–∞–¥–∂–µ–Ω–Ω—è –¥—É–∂–µ –∑—Ä—É—á–Ω–æ –ø—ñ–¥–±–∏—Ä–∞—Ç–∏ –∑–∞ –¥–æ–ø–æ–º–æ–≥–æ—é –¥–∞–Ω–∏—Ö –Ω–∞–≤–µ–¥–µ–Ω–∏—Ö –≤ –¢–∞–±–ª–∏—Ü—è —Ä–æ–∑—á–∏–Ω–Ω–æ—Å—Ç—ñ –Ω–µ–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω.
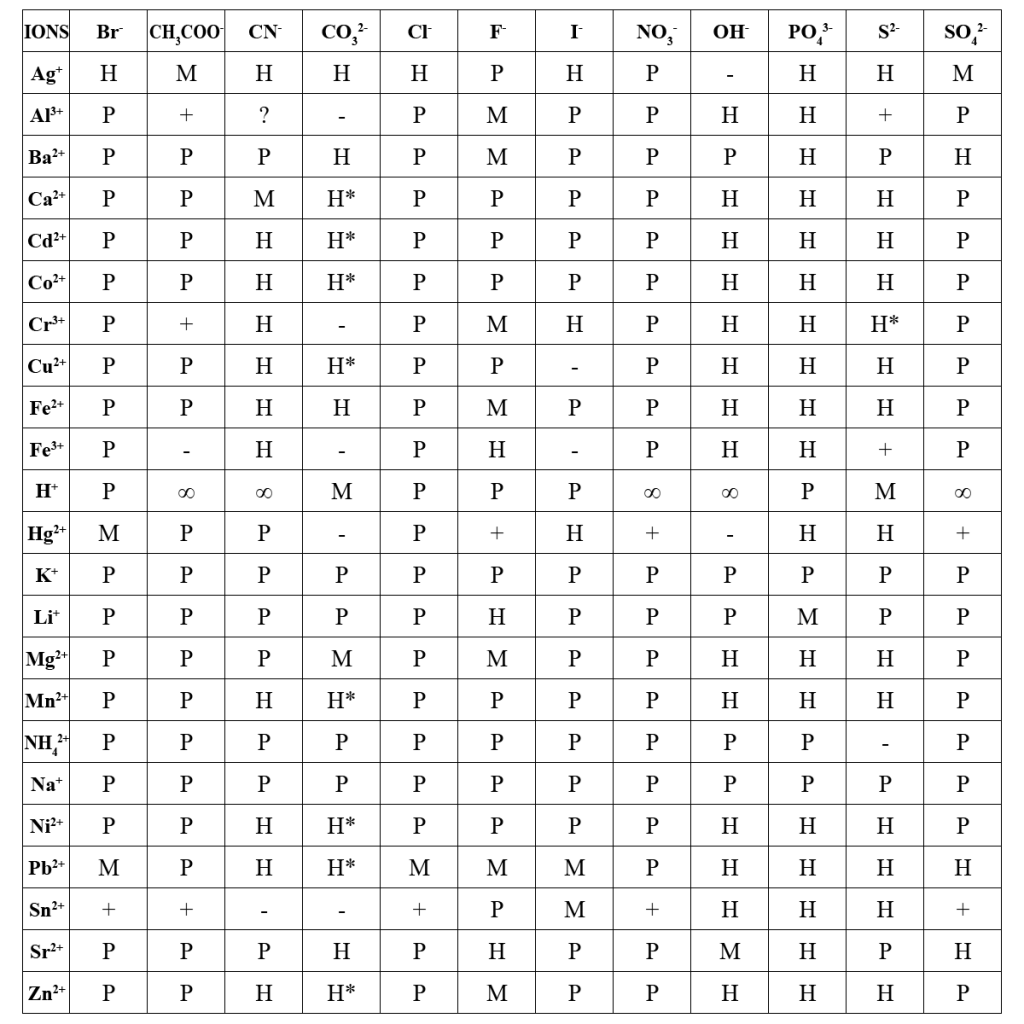
–ü–æ–∑–Ω–∞—á–µ–Ω–Ω—è: –Ý – –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω–∏–π ( > 0,1 –º–æ–ª—å/–¥–º3); –ú – –º–∞–ª–æ—Ä–æ–∑—á–∏–Ω–Ω–∏–π (0,1 – 0,001 –º–æ–ª—å/–¥–º3); –ù – –º–∞–π–∂–µ –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–∏–π ( < 0,001 –º–æ–ª—å/–¥–º3); ‚àû – –Ω–µ–æ–±–º–µ–∂–µ–Ω–æ —Ä–æ–∑—á–∏–Ω–Ω–∏–π; “+” – –ø–æ–≤–Ω—ñ—Å—Ç—é —Ä–µ–∞–≥—É—î –∑ –≤–æ–¥–æ—é; * – –æ—Å–∞–¥ –∑ —Ä–æ–∑—á–∏–Ω—É –Ω–µ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è; “–” – —Ä–µ—á–æ–≤–∏–Ω–∞ –Ω–µ —ñ—Å–Ω—É—î; ? – –¥–∞–Ω—ñ —Ä–æ–∑—á–∏–Ω–Ω–æ—Å—Ç—ñ –≤—ñ–¥—Å—É—Ç–Ω—ñ.
–ü—Ä–∏–∫–ª–∞–¥. –Ø–∫ –∫–æ—Ä–∏—Å—Ç—É–≤–∞—Ç–∏—Å—è —Ç–∞–±–ª–∏—Ü–µ—é —Ä–æ–∑—á–∏–Ω–Ω–æ—Å—Ç—ñ –Ω–µ–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω?
–ü–æ—Ç—Ä—ñ–±–Ω–æ –æ—Ç—Ä–∏–º–∞—Ç–∏ –æ—Å–∞–¥ –º–∞–π–∂–µ –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω–æ–≥–æ —Å—Ç—Ä–æ–Ω—Ü—ñ–π —Å—É–ª—å—Ñ–∞—Ç—É SrSO4. –°–ø–æ—á–∞—Ç–∫—É –ø—ñ–¥–±–∏—Ä–∞—é—Ç—å –≤–∏—Ö—ñ–¥–Ω—É —Ä–æ–∑—á–∏–Ω–Ω—É —Å—ñ–ª—å —Å—Ç—Ä–æ–Ω—Ü—ñ—é, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ —Å—Ç—Ä–æ–Ω—Ü—ñ–π –π–æ–¥–∏–¥ SrI2. –ü–æ—Ç—ñ–º –ø—ñ–¥–±–∏—Ä–∞—é—Ç—å —Ä–æ–∑—á–∏–Ω–Ω–∏–π —Å—É–ª—å—Ñ–∞—Ç –º–µ—Ç–∞–ª—É –∑ —É—Ä–∞—Ö—É–≤–∞–Ω–Ω—è–º —Ç–æ–≥–æ, —â–æ–± –π–æ–≥–æ –π–æ–¥–∏–¥ –±—É–≤ –¥–æ–±—Ä–µ —Ä–æ–∑—á–∏–Ω–Ω–∏–π —É –≤–æ–¥—ñ; –≤ —è–∫–æ—Å—Ç—ñ —Ç–∞–∫–æ—ó —Å–æ–ª—ñ –æ–±–∏—Ä–∞—î–º–æ –∫–∞–ª—ñ–π —Å—É–ª—å—Ñ–∞—Ç K2SO4. –ü—Ä–æ–≤–æ–¥—è—Ç—å —Ä–µ–∞–∫—Ü—ñ—é, –∑–ª–∏–≤–∞—é—á–∏ —Ä–æ–∑–±–∞–≤–ª–µ–Ω—ñ —Ä–æ–∑—á–∏–Ω–∏ –æ–±—Ä–∞–Ω–∏—Ö —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤:
SrI2 + K2SO4 = 2KI + SrSO4‚Üì
Sr2+ + SO42- = SrSO4
–ó–∞–º—ñ—Å—Ç—å K2SO4 –º–æ–∂–Ω–∞ –≤–∑—è—Ç–∏ —ñ —ñ–Ω—à—ñ —Å—É–ª—å—Ñ–∞—Ç–∏, —Ç–∞–∫—ñ —è–∫ Na2SO4 —ñ MgSO4, –∞–ª–µ –Ω–µ –º–æ–∂–Ω–∞ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É–≤–∞—Ç–∏ —Å—É–ª—å—Ñ–∞—Ç–∏ –º–µ—Ç–∞–ª—ñ–≤, —è–∫—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å –∑ –π–æ–¥–æ–º –Ω–µ—Ä–æ–∑—á–∏–Ω–Ω—ñ –π–æ–¥–∏–¥–∏, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, —Ç–∞–∫—ñ —è–∫ Cr2(SO4)3, —Ç–æ–º—É —â–æ —Ö—Ä–æ–º(–Ü–Ü–Ü) –π–æ–¥–∏–¥ –Ω–µ —Ä–æ–∑—á–∏–Ω—è—î—Ç—å—Å—è —É –≤–æ–¥—ñ —ñ –ø—Ä–∏ –ø—Ä–æ–≤–µ–¥–µ–Ω–Ω—ñ —Ä–µ–∞–∫—Ü—ñ—ó –≤ –æ—Å–∞–¥ –≤–∏–ø–∞–¥—É—Ç—å –æ–±–∏–¥–≤–∞ –∫–∞—Ç—ñ–æ–Ω–∏:
3SrI2 + Cr2(SO4)3 = 3SrSO4‚Üì + 2CrI3‚Üì
3Sr2+ + 6I– + 2Cr3+ + 3SO42- = 3SrSO4 + 2CrI3
–Ý–µ–∞–∫—Ü—ñ—ó –æ—Å–∞–¥–∂–µ–Ω–Ω—è –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—é—Ç—å –≤ —Ö—ñ–º—ñ—á–Ω–æ–º—É –∞–Ω–∞–ª—ñ–∑—ñ –¥–ª—è —è–∫—ñ—Å–Ω–æ–≥–æ —ñ –∫—ñ–ª—å–∫—ñ—Å–Ω–æ–≥–æ –≤–∏–∑–Ω–∞—á–µ–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–∏—Ö –µ–ª–µ–º–µ–Ω—Ç—ñ–≤.










