
Для начала два опыта.
Первый весьма прост. Прилейте к раствору азотнокислого серебра (ляписа) в воде каплю раствора поваренной соли. Немедленно образуется белый осадок хлорида серебра.
Второй опыт провести сложнее. Поместите в пробирку несколько капель концентрированной серной кислоты и чрезвычайно осторожно прибавьте к ним по каплям такое же количество концентрированной азотной кислоты. Охладите полученную смесь в кастрюле с холодной водой и прибавьте в пробирку несколько капель бензола. Теперь закройте пробирку пробкой в которую вставлена длинная стеклянная трубка. Нагревайте пробирку в кастрюле с горячей водой при температуре не выше 50*С. Через несколько минут слейте верхний слой в другую пробирку и добавьте к этой жидкости одну-две чайные ложки воды. Получившееся вещество тяжелее воды и опустится на дно пробирки. Вы получили нитробензол – заместили в кольцевой молекуле бензола один атом водорода на группу NO2.
Реакции, как видим, различаются весьма существенно. Если первая протекает за считанные доли секунды при обычной температуре, то вторая требует нагревания в течение нескольких минут.
Дело здесь вот в чем. В первой реакции встречаются два иона – серебра Ag+ и хлора Cl–, и тут же образуется нерастворимое в воде соединение. Столь быстро протекают почти все реакции неорганических ионов.
А теперь о второй реакции. Мы нитруем бензол азотной кислотой в присутствии серной кислоты. Когда мы смешиваем эти две кислоты, происходит химическая реакция, в результате которой образуется так называемый нитроний-катион NO2+:
HNO3 + 2H2SO4 = H3O+ + 2HSO4– + NO2+
В нашем реакционном растворе присутствует еще и бензол. По шестиугольнику его молекулы размазана шестерка так называемых π-электронов. Эти электроны взаимодействуют с нитроний-катионом, образуя π-комплекс.
Описывая реакцию, будем одновременно изображать ее ход на энергетической диаграмме.
На вертикальной оси диаграммы укажем энергию реагирующей системы частиц. Очевидно, если из одной точки диаграммы мы переходим в другую снизу вверх, то система откуда-то приобретает энергию (например, черпает ее из запасов энергии хаотического движения частиц в их взаимных столкновениях). А переход сверху вниз может совершаться за счет собственных, внутренних энергетических запасов системы. Отсюда ясно: чем выше точка на диаграмме, тем неустойчивее соответствующее состояние системы – из такого состояния система может выйти самопроизвольно, без внешних воздействий.
Последовательные участки горизонтальной оси диаграммы будем толковать как стадии реакции. А на протяжении одной какой-то стадии движение вдоль горизонтальной оси можно понимать как перемещения реагирующих частиц, ведущие к образованию промежуточных или конечных продуктов реакции.
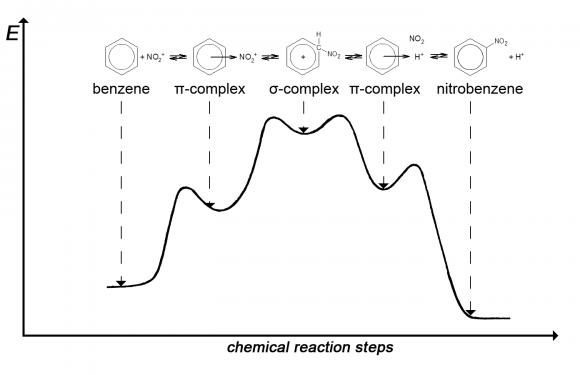
Вот, скажем, самое ее начало. Сближаясь издалека, реагирующие частицы поначалу взаимно отталкиваются, и кривая на диаграмме идет вверх. Провзаимодействовав, частицы образовали относительно устойчивое соединение – кривая несколько снизилась.
Именно так и изобразится на нашей энергетической диаграмме образование π-комплекса бензола с нитроний-катионом. Их комбинация не очень устойчива и может легко распадаться на исходные компоненты. Но может произойти и другой процесс – перестройка молекулы и образование σ-комплекса. При этом нитрониевая частица присоединяется к одному из углеродных атомов.
Следующая стадия нашей реакции – отщепление протона H+ от углеродного атома и образование π-комплекса. Протон в π-комплексе долго не задерживается, и очень скоро образуется нитробензол.
Вот как сложно протекает простая на первый взгляд реакция замены атома водорода в бензоле на нитрогруппу. Эта реакция принадлежит к семейству хорошо известных в химии реакций электрофильного замещения. Здесь электрофильной ( «любящий электроны») частицей выступает нитроний-катион, а бензол – вещество, поставляющее электроны. К электрофильным реакциям относятся хлорирование, бромирование, сульфирование бензола и его аналогов. Электрофильными частицами в таких реакциях могут служить и ионы ртути, и даже атом четырехвалентной платины способен замещать водород в органических соединениях типа бензола.
Мы разобрали последовательность превращений, которые происходят прежде, чем образуется нитропроизводное. Но вот откуда нам известно, какие это превращения, какие промежуточные вещества образуются на пути реакции? Ведь мы имеем исходные вещества, бензол и азотную кислоту, получаем конечное вещество – нитробензол. Каждое из них можно увидеть, взвесить, проанализировать. А что между начальным и конечным веществом? Промежуточные соединения довольно неустойчивы, и их не обнаруживают косвенными методами.
Представьте себе, что вы проводите реакцию и по ее ходу измеряете концентрацию исходного и конечного вещества. Иногда оказывается, что через некоторое время после начала реакции исходное вещество израсходовано в заметной степени, а конечного продукта образовалось еще очень немного. Значит, в реакционной смеси в этот момент находится промежуточное вещество.
Как же установить структуру такого соединения, концентрация которого зачастую весьма невелика? Тут помогают физические методы исследования – например, ядерный магнитный резонанс, инфракрасная и электронная спектроскопия. Эти методы дают информацию о наличии в веществе тех или иных группировок, о порядке, в котором связаны атомы в его молекулах.
Впрочем, иногда промежуточные соединения можно обнаружить даже визуально. На стекле, к капле концентрированной серной кислоты (предельная осторожность!) добавьте нафталин, или фенол (яд!), или анизол (метиловый эфир фенола) и затем крупинку нитрата натрия или калия (можно использовать селитру или ляпис). Ваш раствор окрасится в довольно интенсивный желтый, зеленый или красный цвет (в зависимости от исходных реагентов). Предполагают, что окрашенные вещества – это промежуточные в нитровании σ-комплексы.
Впрочем, недавно исследователи установили, что подобные соединения представляют собой продукт переноса электрона от, скажем, нафталина к иону NO2+. В таком случае механизм, включающий π- и σ-комплексы, оказывается еще более сложным.
А теперь зададимся вопросом: что изучает химия? В школьном учебнике сказано, что химия – наука о веществах и их превращениях. Но вещества исследует и физика и биология… Та же физика интересуется и превращением веществ, например графита в алмаз.
Дело в том, что химические превращения в отличие от прочих характеризуются разрывом одних связей между атомами, составляющими ту или иную молекулу, и образованием новых. Получается, что химию интересуют не столько сами соединения, как таковые, сколько процессы их превращений, химические реакции. Изучая химические реакции, ученые стремятся как можно точнее выяснить, как они протекают, каковы их механизмы. Чтобы используя знания о химических превращениях, создавать новые, полезные в быту и технике вещества.










