Ионные химические реакции – это химические процессы, которые протекают в растворе или в расплаве между свободными ионами
Для ионных реакций характерно, что они протекают очень быстро (практически моментально), т.к. в реакционной системе вещества содержатся в виде ионов, способных к реакции. В этом состоит их отличие от реакций между молекулами, для осуществления которых необходимо обеспечить разрыв химических связей с последующим образованием новых связей. Поэтому молекулярные химические реакции протекают значительно медленнее, чем ионные.
Окислительно-восстановительные химические реакции – это химические реакции, которые сопровождаются изменением степени окисления элементов
Обменные химические реакции – это химические реакции, которые протекают с сохранением степени окисления элементов
Степень протекания обменных реакций с участием ионов в водном растворе зависит от того, в какой мере среди продуктов оказываются слабые электролиты, газы, малорастворимые вещества, которые образуют осадок. В 1803 году французский химик Бертолле сформулировал правило:
Правило Бертолле – Обменные ионные химические реакции протекают практически полностью, если продуктами реакции являются газы, осадки или неэлектролиты
Уравнения ионных химических реакций
Реакции с участием электролитов (истинных электролитов и потенциально сильных электролитов) записываются в виде системы двух уравнений – молекулярного и ионного. Для составления уравнений ионных реакций необходимо знать уравнения электролитической диссоциации реагентов и продуктов.
Как и в молекулярных уравнениях, в ионных уравнениях слева записывают формулы реагентов, а справа – формулы продуктов, указанные в виде отдельных ионов. Формулы слабых потенциальных электролитов, в том числе и воды, а также газообразных и твердых веществ (которые выводятся из водного раствора в виде газа или осадка) оставляют в молекулярном виде.
Пример. В обменной реакции в водном растворе, описываемой молекулярным уравнением
Na2CO3 + 2HCl = 2NaCl + CO2 (газ) + H2O
участвуют Na2CO3 (соль) HCl (кислота) и NaCl (соль) – сильные электролиты, CO2 газ, уходит из реакционной системы, H2O – слабый электролит.
Полное ионное уравнение химической реакции – это формулы всех сильных электролитов в виде сумм составляющих их ионов, и формулы газов, воды, неэлектролитов и нерастворимых веществ записанных в молекулярном виде
2Na+ + CO32- + 2H+ + 2Cl– = 2Na+ + 2Cl– + CO2 + H2O
Ионы Na+ и Cl– в одинаковом количестве присутствуют как слева так и справа в уравнении химической реакции, очевидно, что эти ионы не принимают участия в химической реакции.
Сокращенное ионное уравнение химической реакции – это формулы сильных электролитов в виде сумм составляющих их ионов, и формулы газов, воды, неэлектролитов и нерастворимых веществ записанных в молекулярном виде, которые принимают участие в химической реакции
CO32- + 2H+ = CO2 + H2O
Сокращенные ионные уравнения выражают химическую сущность протекающих реакций между ионами (в данном примере – между карбонат ионами и катионами водорода). Совокупная запись молекулярного и сокращенного ионного уравнения реакции наглядно отображает химизм реакции. Однако отдельно записанные сокращенные ионные уравнения отображают не одну реакцию, а множество подобных реакций. Так, указанное выше сокращенное ионное уравнение реакции между Na2CO3 и HCl означает, что так реагируют между собой не только указанные вещества, но и любой другой хорошо растворимый карбонат (диссоциирующий с образованием CO32-) и любая другая кислота (диссоциирующая с образованием H+). Пример:
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
Cs2CO3 + 2HNO3 = 2CsNO3 + CO2 + H2O
Для обоих химических реакций в приведенном примере подходит сокращенное ионное уравнение
CO32- + 2H+ = CO2 + H2O
Для карбонатов, мало растворимых в воде (например CaCO3) ионное уравнение реакции будет иным.
Молекулярное уравнение химической реакции:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Полное ионное уравнение:
CaCO3 + 2H+ + 2Cl– = Ca2+ + 2Cl– + CO2 + H2O
Сокращенное ионное уравнение:
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
Аналогично записываются реакции с образованием осадков.
Пример.
Молекулярное уравнение химической реакции:
CaCl2 + 2NaF = 2NaCl + CaF2
Полное ионное уравнение:
Ca2+ + 2Cl– + 2Na+ + 2F– = 2Na+ + 2Cl– + CaF2
Сокращенное ионное уравнение:
Ca2+ + 2F– = CaF2
Ионное уравнение этой реакции относится не только к конкретным реагентам (CaCl2 и NaF), но и ко всем хорошо растворимым солям кальция и фторидам:
Ca(NO3)2 + 2KF = 2KNO3 + CaF2
Ca(ClO4)2 + 2NH4F = 2NH4ClO4 + CaF2
Реакции нейтрализации
В соответствии с теорией электролитической диссоциации
Реакция нейтрализации – это взаимодействие катионов водорода и гидроксид-ионов с образованием молекулы воды
Катион водорода + Гидроксид-ион → Вода
H+ + OH– → H2O
С учетом, что катионы водорода находятся в водном растворе в виде ионов H3O+, уравнение реакции нейтрализации записывается в общем виде так:
Катион оксония + Гидроксид-ион → Вода
H3O+ + OH– → 2H2O
Реакции нейтрализации являются одновременно и реакциями солеобразования. В результате взаимодействия сильных оснований с сильными кислотами в водном растворе среда раствора становится нейтральной (pH = 7).
Примеры.
Молекулярное уравнение химической реакции:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Полное ионное уравнение:
Ca2+ + 2OH– + 2H+ + 2NO3– = Ca2+ + 2NO3– + 2H2O
Сокращенное ионное уравнение:
H+ + OH– = H2O
Более современное объяснение реакции нейтрализации дает Протонная теория Бренстеда.
Гидролиз (что такое гидролиз)
Растворы солей, образованных катионами слабых оснований или анионами слабых кислот, имеют либо кислую среду (pH < 7), либо щелочную среду (pH > 7). В рамках ионной теории Аррениуса это объясняется тем, что протекает реакция гидролиза. В общем случае гидролиз определяется как взаимодействие соли с водой:
Соль + Вода → Кислота + Основание
Гидролиз – это химическая реакция, обратная нейтрализации, в результате которой происходит образование кислоты и основания
Кислота + Основание ⇄ Соль + Вода
Возможность и характер протекания гидролиза определяется природой соли, т.е. природой кислоты и основания, из которых образована соль.
- Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, их водные растворы имеют нейтральную среду (например, NaCl, K2SO4, NaNO3). См. Пример 1.
- Водные растворы солей, образованных анионами слабых кислот и катионами сильных оснований, имеют щелочную среду (например, Na2CO3, KNO2, CH3COONa). См. Пример 2.
- Водные растворы солей, образованных катионами слабых оснований и анионами сильных кислот, имеют кислую среду (например, NH4NO3, FeCl3). См. Пример 3.
- Для хорошо растворимых солей, образованных анионами слабой кислоты и катионами слабого основания, реакция растворов зависит от степени протекания обратимых стадий взаимодействия с водой. См. Пример 4.
Пример 1.
Гидролиз солей сильных кислот и сильных оснований отсутствует, происходит растворение соли и процесс гидратации ионов:
K2SO4 + nmH2O = 2K+*nH2O + SO42-*mH2O
Пример 2.
Нитрит натрия NaNO2 – соль сильного основания NaOH и слабой кислоты HNO2. Соль NaNO2 диссоциирует в водном растворе на катионы натрия и нитрит-ионы, а на последующей стадии нитрит-ионы обратимо реагируют с водой:
NaNO2 = Na+ + NO2–
NO2– + H2O ⇄ HNO2 + OH–
В результате гидролиза реакция раствора нитрита натрия щелочная (pH > 7).
Если соль образована анионами многоосновной слабой кислоты, то продуктом реакции гидролиза будет гидроанион – анион кислотного остатка, содержащий водород.
Например, гидролиз карбоната натрия описывается следующими двумя стадиями:
Na2CO3 = 2Na+ + CO32-
CO32- + H2O ⇄ HCO3– + OH–
Следует обратить внимание на распространенную ошибку при составлении уравнения реакции гидролиза.
Нельзя в уравнении гидролиза использовать более, чем одну молекулу воды – это неправильно!
Правильно: CO32- + H2O ⇄ HCO3– + OH–
Неправильно: CO32- + 2H2O ⇄ H2CO3 + 2OH–
Последняя запись неверна потому, что накопление в растворе гидроксид-ионов OH– обязательно приведет к обратной реакции – частичной нейтрализации угольной кислоты:
H2CO3 + OH- = HCO3– + H2O
Поэтому действительным продуктом гидролиза растворимых карбонатов (Na2CO3, K2CO3) является гидрокарбонат-ион HCO3–, а не угольная кислота. Правильность этого утверждения доказывает отсутствие выделения диоксида углерода из растворов карбонатов. Если бы гидролиз протекал до образования больших количеств угольной кислоты, то вследствие ее неустойчивости при большой концентрации в растворе обязательно наблюдалось бы віделение газа:
H2CO3 = H2O + CO2
Пример 3.
Еще один пример касается гидролиза соли образованной сильной кислотой и слабым основанием, например нитрат аммония NH4NO3:
NH4NO3 = NH4+ + NO3–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
В результате гидролиза раствор нитрата аммония имеет кислую среду (pH < 7).
Если соль образована катионами многоосновных оснований, то продуктом гидролиза будет гидроксокатион основания.
Например, гидролиз сульфата железа(II) протекает по следующим двум стадиям:
FeSO4 = Fe2+ + SO42-
Fe2+ + H2O ⇄ FeOH– + H+; H+ + H2O = H3O+ (pH < 7)
Неправильной будет следующая запись реакции гидролиза:
Fe2+ + 2H2O ⇄ Fe(OH)2 + 2H+
Если бы данная реакция происходила, мы наблюдали бы образование осадка Fe(OH)2, вследствие его малой растворимости (5e-5 г. в 100 г. H2O), однако осадок не образуется.
Пример 4.
Гидролиз нитрита аммония протекает по следующим стадиям:
NH4NO2 = NH4+ + NO2–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
NO2– + H2O ⇄ HNO2 + OH–
Известно, что гидролиз катионов аммония протекает полнее, следовательно, больше образуется катионов H+ (по сравнению с анионами OH–) поэтому раствор будет слабокислым (pH < 7).
Обратите внимание и сравните константы ионизации кислот и оснований, которыми образована соль:
Константа ионизации NH3*H2O = 1,76e-5
Константа ионизации HNO2 = 5,10e-4
Гидролиз ацетата аммония протекает по следующим стадиям:
CH3COONH4 = NH4+ + CH3COO–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
CH3COO– + H2O ⇄ CH3COOH + OH–
Степень протекания обеих обратимых реакций одинаковая, поэтому раствор ацетата аммония нейтральный (pH = 7).
Обратите внимание и сравните константы ионизации кислот и оснований, которыми образована соль:
Константа ионизации NH3*H2O = 1,76e-5
Константа ионизации CH3COOH = 1,74e-5
Раствор цианида аммония имеет сильнощелочную среду (pH > 7) вследствие большей степени протекания реакции гидролиза цианид-иона:
NH4CN = NH4+ + CN–
NH4+ + H2O ⇄ NH3*H2O + H+; H+ + H2O = H3O+
CN– + H2O ⇄ HCN + OH–
Обратите внимание и сравните константы ионизации кислот и оснований, которыми образована соль:
Константа ионизации NH3*H2O = 1,76e-5
Константа ионизации HCN = 5,00e-10
В водных растворах кислых солей протекают одновременно, но в разной степени две обратимые реакции – диссоциация гидроаниона и его гидролиз, что и определяет среду раствора.
Например, водный раствор гидросульфита натрия NaHSO3 имеет кислую реакцию (pH < 7):
NaHSO3 = Na+ + HSO3–
HSO3– ⇄ H+ + SO32-; H+ + H2O = H3O+
HSO3– + H2O ⇄ SO2*H2O + OH–
Водный раствор гидроортофосфата натрия Na2HPO4 имеет щелочную среду (pH > 7):
Na2HPO4 = 2Na+ + HPO42-
HPO42- ⇄ H+ + PO43-; H+ + H2O = H3O+
HPO42- + H2O ⇄ H2PO4– + OH–
Поэтому название “кислые соли” не должно вводить в заблуждение, что реакция растворов таких солей всегда кислая.
Обратимая реакция гидролиза соли протекает тем полнее, чем более слабыми являются образующие соль кислота и/или основание. Так, из основания и кислоты, образующих цианид аммония NH4CN, более слабым электролитом является циановодород, чем гидрат аммиака. Поскольку реакция раствора обеспечивается относительно более сильным электролитом, то раствор цианида аммония должен быть щелочным.
Если соль образована более сильной кислотой (по сравнению с силой основания), то раствор соли будет кислым;
Если соль образована более сильным основанием (по сравнению с силой кислоты), то раствор будет щелочным
В рамках ионной теории Аррениуса механизм протекания гидролиза можно объяснить следующим образом. Вода подвергается, хотя и в очень незначительной степени, автодиссоциации:
H2O ⇄ H+ + OH–
Если в воду (при растворении солей и их полной диссоциации) вводятся анионы, которые могут образовывать с катионами водорода малодиссоциирующие молекулы или ионы, то некоторое количество ионов H+ оказывается связанным, а равное количество ионов OH– остается свободным, обусловливая щелочную среду раствора (сильное основание + слабая кислота = соль). Наоборот, если катионы соли связывают некоторое количество ионов OH–, то равное количество ионов H+ остается свободным, обусловливая кислую среду раствора (слабое основание + сильная кислота = соль).
Na2S = 2Na+ + S2-; H2O ⇄ H+ + OH–
H+ + S2- ⇄ HS–; pH > 7
Fe(NO3)3 = Fe3+ + 3NO3–; H2O ⇄ H+ + OH–
Fe3+ + OH– ⇄ FeOH2+; pH < 7
Реакции осаждения
Электролиты (кислоты, основания, соли) обладают различной растворимостью в воде. При смешивании растворов двух хорошо растворимых электролитов возможно образование малорастворимых веществ, образующих осадки в растворе.
Реакции осаждения – это ионные реакции, протекающие с образованием малорастворимых веществ
Чем ниже растворимость образующегося вещества, тем меньше свободных ионов этого вещества остается в растворе, а значит, в большей степени реакция приближается к необратимой.
Пример.
AgNO3 + NaCl = NaNO3 + AgCl↓
Ag+ + Cl– = AgCl
Растворимость хлорида серебра(I) составляет 1e-5 моль/дм3. Следовательно, после смешивания, например 0,01М растворов нитрата серебра(I) и хлорида натрия, в конечном растворе остаточная концентрация ионов Ag+ и Cl– чрезвычайно низкая, поскольку основное количество этих ионов переходит в осадок AgCl.
Хлорид серебра(I) AgCl можно получить также из других хорошо растворимых реагентов:
2AgClO4 + BaCl2 = 2AgCl + Ba(ClO4)2
AgNO3 + HCl = HNO3 + AgCl
При выборе реагентов для проведения реакции осаждения следует учитывать, что и второй продукт реакции может оказаться нерастворимым. Например:
2AgF + CaCl2 = 2AgCl↓ + CaF2↓
Заметьте, для данной химической реакции полное ионное уравнение этой реакции сокращению не поддается, т.к. все ионы образуют малорастворимые продукты
2Ag+ + 2F– + Ca2+ + 2Cl– = 2AgCl + CaF2
В аналитической химии образование осадка AgCl часто используется для обнаружения как катионов серебра(I), так и хлорид ионов. При анализе раствора на присутствие катионов Ag+ к нему добавляют несколько капель разбавленного HCl или NaCl; если раствор испытывают на присутствие Cl–, то к нему добавляют несколько капель разбавленного раствора AgNO3.
Другой, очень распространенной качественной реакцией в аналитической химии является образование практически нерастворимого сульфата бария BaSO4.
Ba2+ + SO42- = BaSO4
Эту реакцию можно использовать как для качественного так и для количественного обнаружения катионов бария или сульфат-ионов в растворе.
Подбор реагентов для реакций осаждения очень удобно проводить с помощью данных приведенных в Таблица растворимости неорганических веществ.
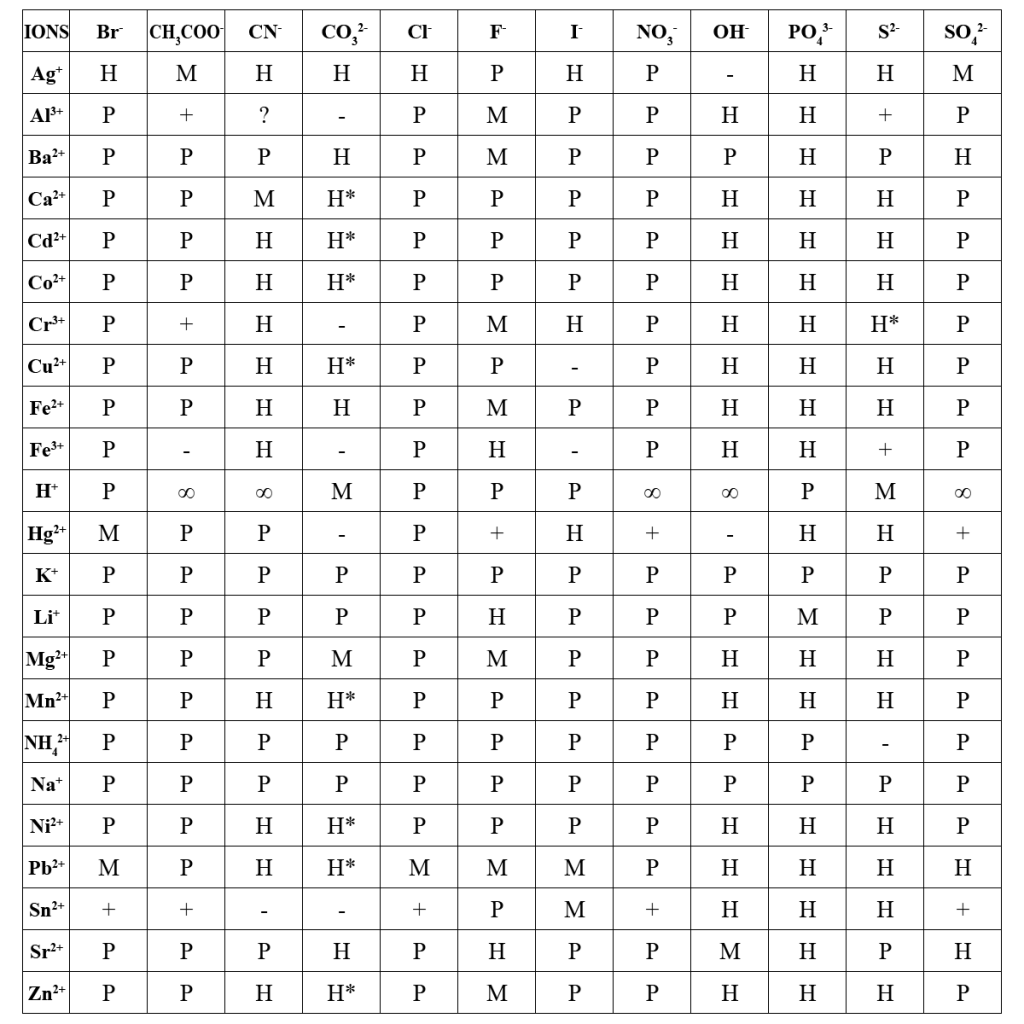
Обозначения: Р – хорошо растворимый (> 0,1 моль/дм3); М – малорастворимый (0,1 – 0,001 моль/дм3); Н – почти нерастворимый (< 0,001 моль/дм3); ∞ – неограниченно растворимый; “+” – полностью реагирует с водой; * – осадок из раствора не образуется; “–” – вещество не существует; ? – данные по растворимости отсутствуют.
Пример. Как пользоваться таблицей растворимости неорганических веществ?
Требуется получить осадок почти нерастворимого сульфата стронция SrSO4. Вначале подбирают исходную растворимую соль стронция, например иодид стронция SrI2. Затем подбирают растворимый сульфат металла с учетом того, чтобы его иодид был хорошо растворим в воде; такой солью может служить сульфат калия K2SO4. Проводят реакцию, сливая разбавленные растворы выбранных реагентов:
SrI2 + K2SO4 = 2KI + SrSO4↓
Sr2+ + SO42- = SrSO4
Вместо K2SO4 можно взять и другие сульфаты, такие как Na2SO4 и MgSO4, но нельзя использовать Cr2(SO4)3, т.к. иодид хрома(III) нерастворим в воде и при проведении реакции в осадке окажутся сразу оба продукта, что не дает возможности сделать однозначный вывод о присутствии в растворе ионов Sr2+:
3SrI2 + Cr2(SO4)3 = 3SrSO4↓ + 2CrI3↓
3Sr2+ + 6I– + 2Cr3+ + 3SO42- = 3SrSO4 + 2CrI3
Реакции осаждения используют в химическом анализе для качественного и количественного определения химических элементов.










